-
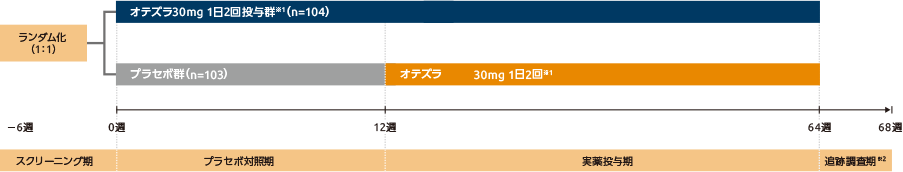
試験デザイン
国際共同第Ⅲ相臨床試験(BCT-002試験:RELIEF試験)1、2)
【目的】
口腔潰瘍を有する活動性ベーチェット病患者にオテズラを経口投与したときの有効性及び安全性を評価する。
【対象】
International Study Group(ISG)基準によりベーチェット病と診断された患者のうち、スクリーニング時に口腔潰瘍を有し※3、割付け前の12ヵ月間に少なくとも3回口腔潰瘍を発症しており、ベーチェット病による口腔潰瘍に対する治療歴がある患者207例(うち日本人は39例)。
【方法】
第Ⅲ相多施設共同、ランダム化、二重盲検、プラセボ対照並行群間比較試験。本試験は、スクリーニング期(最長6週)、プラセボ対照期(12週、二重盲検)、実薬投与期(52週、二重盲検)及び追跡調査期(4週)で構成された。プラセボ対照期では、性別、ぶどう膜炎の既往の有無、及び地域(日本、日本以外)で層別し、オテズラ30mg 1日2回投与群(オテズラ30mgを1日2回投与)又はプラセボ群(プラセボを1日2回投与)のいずれかに1:1でランダムに割付け、12週投与した。実薬投与期では、プラセボ対照期での盲検性を維持したまま、全例をオテズラ30mg 1日2回投与とし、52週投与した。併用治療の規定として、有効性評価への影響を考慮して、プラセボ対照期はベーチェット病に対する治療(全身及び局所)は不可とした。また、プラセボ対照期終了後の実薬投与期では、口腔潰瘍の部分寛解や完全寛解に到達しない患者に対してコルヒチン※4や副腎皮質ステロイド(外用)の使用は可とした。ベーチェット病による眼疾患又は他の眼疾患に対しては、プラセボ対照期、実薬投与期のいずれでも副腎皮質ステロイド点眼剤の使用は可とした。経口/局所鎮痛薬(リドカインゲル※5)とクロルヘキシジン※6の使用も可(口腔潰瘍又は外陰部潰瘍の疼痛の評価を妨げないよう評価来院前24時間のみ使用は不可)とした。
【主要評価項目】
投与12週時までの口腔潰瘍数の時間曲線下面積(AUC)※7(検証的な解析項目)
【副次評価項目】
投与12週時の口腔潰瘍疼痛VAS※8スコアのベースラインからの変化量、投与12週時のベーチェット病活動性尺度(BSAS)※9スコアのベースラインからの変化量、投与6週時までに口腔潰瘍が完全寛解し、6週以上持続した患者割合、投与12週時の口腔潰瘍の完全寛解割合、投与12週時のベーチェット病QOL(BD QOL)※10スコアのベースラインからの変化量等
【その他の評価項目】
投与64週時までの口腔潰瘍数、投与64週時の口腔潰瘍疼痛VASスコアのベースラインからの変化量、投与64週時のBSASスコアのベースラインからの変化量、投与64週時のBD QOLのベースラインからの変化量等
【解析計画】
有効性はITT集団※11を主解析対象集団として評価した。有効性の主要評価項目及び副次評価項目の多重性の調整にはゲートキーピング法を用いた。主要評価項目に対しては、投与群、性別、地域を因子(日本人集団では投与群、性別を因子)、ベースラインの口腔潰瘍数を共変量とした共分散分析を用いてプラセボ群とオテズラ30mg 1日2回投与群を比較した(有意水準:両側0.05)。口腔潰瘍数の欠測値は多重代入(MI:multiple imputation)法を用いて補完した。ベースラインの患者背景、ベースラインの疾患特性、地域によるサブグループ解析を行った。副次評価項目の検定は、多重比較に伴う第一種の過誤率を制御するために副次評価項目に記載した順(一部)で階層的に行った(有意水準:両側0.05)。日本人集団の解析では多重性を考慮しなかった。疼痛に対するVAS評価のような連続変数では要約統計量(評価患者数、平均値、中央値、標準偏差、最小値、最大値等)を算出した。12週時で評価する項目に対しては、主要評価項目と同様に投与群、性別、地域を因子(日本人集団では投与群、性別を因子)、ベースライン値を共変量とした共分散分析モデルを用いて群間比較した。口腔潰瘍の完全寛解までの期間については性別、地域を因子とした層別log-rank検定を用いて群間比較した。口腔潰瘍に対して奏効を示した患者割合といったカテゴリー変数では、患者数とその割合(%)を算出し、性別及び地域(日本人集団では性別のみ)で調整したCMH(Cochran-Mantel-Haenszel)検定を用いて群間比較した。投与12週時より前に中止した患者や12週時のデータがない患者はnon-responderとして取り扱った。安全性は安全性解析対象集団及びオテズラ30mg 1日2回投与集団を対象集団として評価した。
- オテズラ投与開始時は、最初の6日間にオテズラを1日あたり10mgずつ漸増投与した。
- 何らかの理由で治験薬の投与を中止した患者を含む。
- スクリーニング時に2個以上の口腔潰瘍を有し、かつ(1)その14日以上後のランダム割付け日に2個以上の口腔潰瘍を有する、又は(2)その1~42日後のランダム割付け日に3個以上の口腔潰瘍を有する患者とした。
- コルヒチンは国内においてベーチェット病に対して未承認であるが、「55年通知」に基づきベーチェット病に対する保険適用が認められている3)。
- ゲル剤は国内未承認である。
- 国内ではクロルヘキシジングルコン酸塩として承認されている。
- AUC(Area under the curve):投与開始日、投与1、2、4、6、8、10、12週時の口腔潰瘍数を測定し、線形台形法で各測定時点間のAUCを算出した。
- VAS(Visual analog scale):視覚的評価スケール。口腔潰瘍に伴う疼痛の程度はVAS(100mm)を用いて評価した。直近1週間に発現した口腔潰瘍に伴う疼痛の程度を0mm(痛みなし)から100mm(最大の疼痛)とするVAS上に患者が印を付け、その位置をスコア化した。
- BSAS(Behçetʼs syndrome activity score):ベーチェット病活動性尺度。口腔潰瘍、外陰部潰瘍、皮膚病変、消化管病変、中枢神経病変、血管病変、眼病変を評価する計10個の質問で構成され、0から100(100が最も疾患活動性が高い)のスケールで評価する。患者が入力を行った。
- BD QOL(Behçetʼs disease quality of life questionnaire):患者の生活に対するベーチェット病の影響を評価する尺度。BD QOL質問票は30項目で構成されており、0(QOLに対する疾患の悪影響なし)から30(QOLに対する疾患の悪影響が最大)のスケールで評価する。患者が入力を行った。
- ITT(Intent-to-treat)集団:ランダム割付けされ、治験薬が1回以上投与された患者集団。
4. 効能又は効果(一部抜粋)
○局所療法で効果不十分なベーチェット病による口腔潰瘍
6. 用法及び用量
通常、成人にはアプレミラストとして以下のとおり経口投与し、6日目以降はアプレミラストとして1回30mgを1日2回、朝夕に経口投与する。
1日目 2日目 3日目 4日目 5日目 6日目以降 朝 朝 夕 朝 夕 朝 夕 朝 夕 朝 夕 10mg 10mg 10mg 10mg 20mg 20mg 20mg 20mg 30mg 30mg 30mg -
患者背景・疾患特性
患者背景
全体集団 日本人集団 プラセボ群 (n=103) オテズラ30mg 1日2回投与群 (n=104) プラセボ群 (n=20) オテズラ30mg 1日2回投与群 (n=19) 年齢(歲)、平均値±SD 40.6±12.7 39.4±12.1 44.7±13.5 44.3±10.8 性別、n(%) 男性 40(38.8) 40(38.5) 7(35.0) 6(31.6) 女性 63(61.2) 64(61.5) 13(65.0) 13(68.4) 人種、n(%) アメリカインディアン/
アラスカ先住民1(1.0) 0(0.0) 0(0.0) 0(0.0) アジア人 30(29.1) 32(30.8) 20(100.0) 19(100.0) 黒人/アフリカ系アメリカ人 0(0.0) 1(1.0) 0(0.0) 0(0.0) ハワイ先住民/
その他の太平洋諸島系住民1(1.0) 0(0.0) 0(0.0) 0(0.0) 白人 68(66.0) 69(66.3) 0(0.0) 0(0.0) 未収集/未報告 3(2.9) 2(1.9) 0(0.0) 0(0.0) 体重(kg)、平均値±SD 70.0±16.4 66.4±16.0 57.0±9.5 56.9±9.7 BMI(kg/m²)、平均値±SD 25.6±5.8 24.1±4.5 21.7±2.6 21.8±2.8 口腔潰瘍数(個)、平均値±SD 3.9±2.7 4.2±3.7 3.7±2.0 3.8±1.2 口腔潰瘍疼痛VASスコア(mm)、平均値±SD 60.8±26.9 61.2±27.6 61.7±26.8 54.3+30.2 BSASスコア、平均値±SD 44.3±16.9 42.8±16.2 38.6±17.9 37.9±17.8 BD QOLスコア、平均値±SD 11.2±8.2 10.2±8.2 6.7±5.3 5.7±6.6 疾患特性
全体集団 日本人集団 プラセボ群 (n=103) オテズラ30mg 1日2回投与群 (n=104) プラセボ群 (n=20) オテズラ30mg 1日2回投与群 (n=19) ベーチェット病の罹病期間(年)、平均值±SD 6.9±8.0 6.7±7.4 3.8±3.6 5.9±5.2 再発性のアフタ性口腔潰瘍、n(%) 103 (100.0) 104 (100.0) 20 (100.0) 19 (100.0) 外陰部潰瘍、n(%) 91 (88.3) 96 (92.3) 19 (95.0) 17 (89.5) 皮膚病変※1 、n(%) 102 (99.0) 102 (98.1) 20 (100.0) 19 (100.0) 筋骨格系病変※2、n(%) 80 (77.7) 70 (67.3) 16 (80.0) 16 (84.2) 消化管病変※3 、n(%) 11 (10.7) 8 (7.7) 3 (15.0) 2 (10.5) 眼病変※4 、n(%) 19 (18.4) 17 (16.3) 4 (20.0) 3 (15.8) 中枢神経病変※5 、n(%) 8 (7.8) 12 (11.5) 2 (10.0) 3 (15.8) 血管病変※6 、n(%) 1 (1.0) 2 (1.9) 0 (0.0) 2 (10.5) - 痤瘡様病変(Acne-Like Lesions)、痤瘡様病変(Acneiform Lesions/Acne-Like Lesions)、結節性紅斑、毛包炎、毛包炎/偽性毛包炎、丘疹膿疱性病変、パテルギーテスト(陽性)、皮下血栓性静脈炎等を含む。
- 関節痛、強直を伴う関節炎、強直を伴わない関節炎、線維筋痛、筋肉痛等を含む。
- 腹痛、出血(消化管)、下痢、回盲部潰瘍、悪心、嘔吐等を含む。
- 前部ぶどう膜炎/虹彩毛様体炎、後部ぶどう膜炎等を含む。
- ベーチェット病による頭痛、脳卒中様症状(錯乱、脱力、浮動性めまい)を含む。
- 動脈瘤、血栓性静脈炎を含む。
注) 過去又は現在の症状
-
ベーチェット病による口腔潰瘍※数に対する効果
※ 承認された効能又は効果(一部抜粋)は「局所療法で効果不十分なベーチェット病による口腔潰瘍」である。
オテズラ錠の投与により、投与12週時までの口腔潰瘍数のAUCは、プラセボ群に比べて改善しました
投与12週時までの口腔潰瘍数のAUC[全体集団:主要評価項目(検証的な解析結果)、日本人集団:サブグループ解析]
全体集団において、投与12週時までの口腔潰瘍数のAUCの最小二乗平均(両側95%CI)は、オテズラ30mg 1日2回投与群では129.5(98.1~161.0)であり、プラセボ群の222.1(190.8~253.5)に比べて統計学的に有意に小さい結果でした(群間差[両側95%CI]:-92.6[-130.6~-54.6]、p<0.0001、共分散分析[因子:治療群、性別、地域、共変量:ベースラインの口腔潰瘍数])。オテズラ30mg 1日2回投与群ではプラセボ群に比べてAUCが42%減少しました。
投与12週時までの口腔潰瘍数のAUCの最小二乗平均(両側95%CI)は、オテズラ30mg 1日2回投与群では115.9(33.4 ~198.3)であり、プラセボ群の253.3(174.9~331.7)に比べて小さかった(群間差[両側95%CI]:−137.5[−248.4~−26.5]、p=0.0168、名目上のp値、共分散分析[因子:治療群、性別、共変量:ベースラインの口腔潰瘍数])。
注)投与12週時の来院日が投与85日目ではない場合には、総AUCを全試験期間(日)で除した値に84(日)を乗じることにより投与12週時までのAUCを算出した。
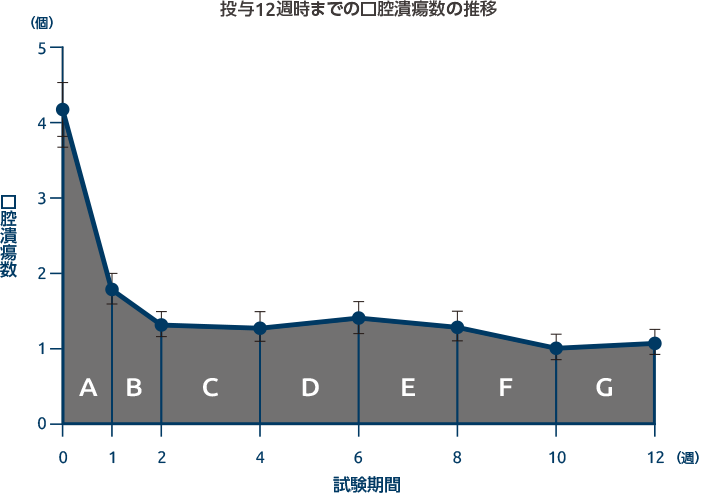
口腔潰瘍数の時間曲線下面積(AUC)について
- ベーチェット病による口腔潰瘍は増悪と寛解を繰り返す。ベースラインから投与12週時までの口腔潰瘍数のAUCを用いることで、プラセボ対照期全体を通しての、オテズラ錠のベーチェット病による口腔潰瘍数に対する効果を評価できると考え、主要評価項目に設定した。
- AUCは、口腔潰瘍数の時間経過を示した折れ線と、横軸(時間軸)で囲まれた部分の面積(図中の灰色の部分)をさす。
- 本試験では、口腔潰瘍数の平均を投与開始日、投与1、2、4、6、8、10、12週時に測定し、線形台形法により各測定時のAUCを算出した。ベースラインから投与12週時までの口腔潰瘍数のAUCは、各測定時のAUC(図A~G)の合計である。
- AUCが小さいほど、期間を通じての口腔潰瘍数の平均が少ないことを示唆する。
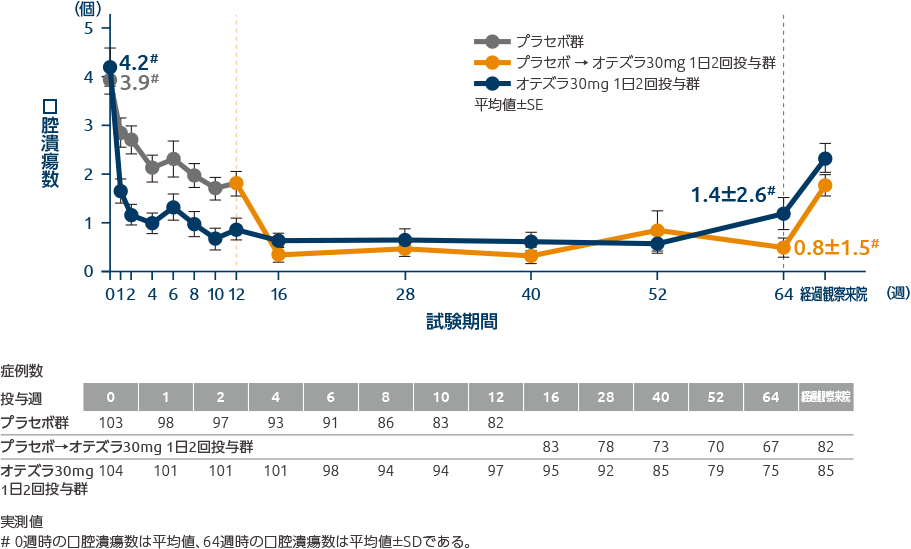
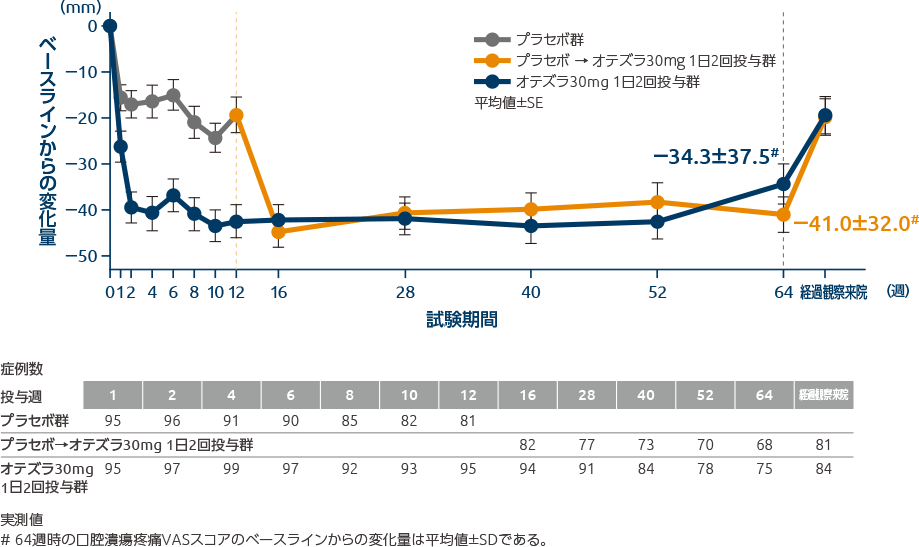
投与64週時の口腔潰瘍数の平均値は、プラセボ→オテズラ30mg 1日2回投与群0.8個、オテズラ30mg 1日2回投与群1.4個でした
投与64週時までの口腔潰瘍数の推移(全体集団:その他の評価項目)
投与64週時の口腔潰瘍数の平均値は、プラセボ→オテズラ30mg 1日2回投与群0.8個、オテズラ30mg 1日2回投与群1.4個でした。
-
ベーチェット病による口腔潰瘍※疼痛の改善
※ 承認された効能又は効果(一部抜粋)は「局所療法で効果不十分なベーチェット病による口腔潰瘍」である。
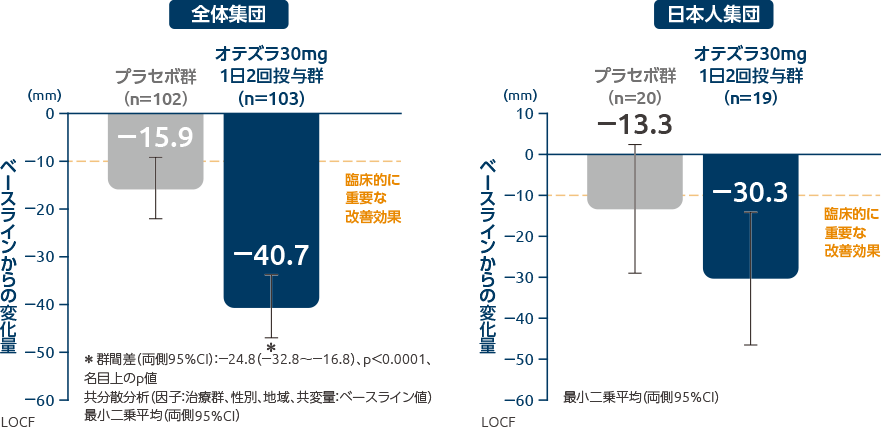
オテズラ錠の投与により、投与12週時の口腔潰瘍疼痛VASスコアは改善しました
投与12週時の口腔潰瘍疼痛VASスコアのベースラインからの変化量
(全体集団:副次評価項目、日本人集団:サブグループ解析)
全体集団において、投与12週時の口腔潰瘍疼痛VASスコアのベースラインからの変化量の最小二乗平均(両側95%CI)は、オテズラ30mg 1日2回投与群では-40.7mm(-47.3~-34.1)であり、プラセボ群の-15.9mm(-22.4~-9.4)に比べて統計学的に有意に大きい値でした(群間差[両側95%CI]:-24.8[-32.8~-16.8]、p<0.0001、名目上のp値、共分散分析[因子:治療群、性別、地域、共変量:ベースライン値])。
日本人集団において、投与12週時の口腔潰瘍疼痛VASスコアのベースラインからの変化量の最小二乗平均(両側95%CI)は、オテズラ30mg 1日2回投与群-30.3mm(-46.6~-14.0)、プラセボ群-13.3mm(-29.0~2.4)でした。最小二乗平均の2群間の差(両側95%CI)は-17.0(-39.1~5.1)でした。
臨床的に重要な改善効果はベースラインからの変化量が10mm以上とされている。
Dworkin RH et al.: J Pain. 9: 105-121, 2008投与64週時の口腔潰瘍疼痛VASスコアの変化量は、プラセボ→オテズラ投与群
-41.0mm、オテズラ投与群-34.3mmでした投与64週時の口腔潰瘍疼痛VASスコアのベースラインからの変化量の推移(全体集団:その他の評価項目)
投与64週時の口腔潰瘍疼痛VASスコアのベースラインからの変化量の平均値は、プラセボ→オテズラ30mg 1日2回投与群-41.0mm、オテズラ30mg 1日2回投与群-34.3mmでした。
-
ベーチェット病による口腔潰瘍※の完全寛解
※ 承認された効能又は効果(一部抜粋)は「局所療法で効果不十分なベーチェット病による口腔潰瘍」である
オテズラ投与群では、投与12週時に口腔潰瘍が完全寛解していた患者割合は、プラセボ群に比べて高い値でした
投与12週時の口腔潰瘍の完全寛解割合(全体集団:副次評価項目、日本人集団:サブグループ解析)
全体集団において、投与12週時に口腔潰瘍が完全寛解していた患者割合は、オテズラ30mg 1日2回投与群では52.9%(55/104例)であり、プラセボ群の22.3%(23/103例)に比べて統計学的に有意に高い値でした(群間差[両側95%CI]:30.6%[18.1~43.1]、p<0.0001、名目上のp値、CMH検定[層別因子:性別、地域])。
日本人集団において、投与12週時に口腔潰瘍が完全寛解していた患者割合は、オテズラ30mg 1日2回投与群では57.9%(11/19例)であり、プラセボ群の25.0%(5/20例)に比べて高い値でした(群間差[両側95%CI]:32.8%[3.7~61.9]、p=0.0426、名目上のp値、CMH検定[層別因子:性別])。
オテズラ投与群では、投与6週時までに口腔潰瘍が完全寛解し、6週以上持続した患者割合は、プラセボ群に比べて高い値でした
投与6週時までに口腔潰瘍が完全寛解し、6週以上持続した患者割合
(全体集団:副次評価項目、日本人集団:サブグループ解析)全体集団において、投与6週時までに口腔潰瘍が完全寛解し、かつその完全寛解が6週以上持続した患者割合は、オテズラ30mg 1日2回投与群では29.8%(31/104例)であり、プラセボ群の4.9%(5/103例)に比べて統計学的に有意に高い値でした(群間差[両側95%CI]:25.1%[15.5~34.6]、p<0.0001、名目上のp値、CMH検定[層別因子:性別、地域])。
日本人集団において、投与6週時までに口腔潰瘍が完全寛解し、かつその完全寛解が6週以上持続した患者割合は、オテズラ30mg 1日2回投与群47.4%(9/19例)、プラセボ群0%(0/20例)でした。2群間の差(両側95%CI)は47.4%(25.0~69.9)でした。
-
BSAS・BD QOL
投与12週時のBSASスコアのベースラインからの変化量(全体集団:副次評価項目)
投与12週時のBSASスコアのベースラインからの変化量の最小二乗平均(両側95%CI)は、オテズラ30mg 1日2回投与群では-17.4(-20.9~-13.8)であり、プラセボ群の-5.4(-8.9~-1.9)に比べて統計学的に有意に減少しました(群間差[両側95%CI]:-11.9[-16.2~-7.7]、p<0.0001、名目上のp値、共分散分析[因子:治療群、性別、地域、共変量:ベースライン値])。
投与64週時のBSASスコアのベースラインからの変化量(全体集団:その他の評価項目)
投与64週時のBSASスコアのベースラインからの変化量の平均値(両側95%CI)は、プラセボ→オテズラ30mg 1日2回投与群-16.6(-20.9~-12.4)、オテズラ30mg 1日2回投与群-16.9(-21.9~-11.9)でした。
投与12週時のBD QOLスコアのベースラインからの変化量(全体集団:副次評価項目)
投与12週時のBD QOLスコアのベースラインからの変化量の最小二乗平均(両側95%CI)は、オテズラ30mg 1日2回投与群では-3.5(-4.8~-2.2)であり、プラセボ群の-0.5(-1.8~0.8)に比べて統計学的に有意に減少しました(群間差[両側95%CI]:-3.0[-4.5~-1.4]、p=0.0003、名目上のp値、共分散分析[因子:治療群、性別、地域、共変量:ベースライン値])。
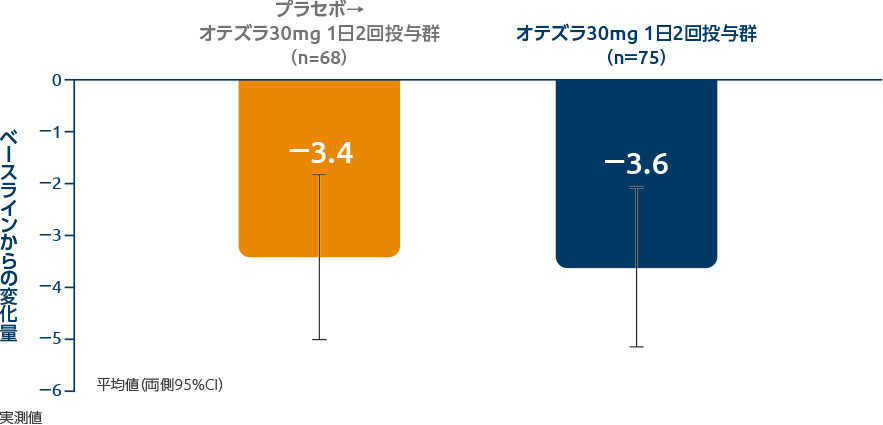
投与64週時のBD QOLスコアのベースラインからの変化量(全体集団:その他の評価項目)
投与64週時のBD QOLスコアのベースラインからの変化量の平均値(両側95%CI)は、プラセボ→オテズラ30mg 1日2回投与群-3.4(-5.0~-1.8)、オテズラ30mg 1日2回投与群-3.6(-5.1~-2.0)でした。
承認された効能又は効果(一部抜粋)は「局所療法で効果不十分なベーチェット病による口腔潰瘍」である。
-
安全性
プラセボ対照期及び実薬投与期の副作用発現率は以下の通りで、主な副作用は下痢、悪心、頭痛などでした
プラセボ対照期(全体集団)における安全性の概要
n(%) プラセボ群
(n=103)オテズラ30mg 1日2回投与群
(n=104)副作用 37 (35.9) 60 (57.7) 主な副作用(いずれかの群で5%以上発現) 下痢 14 (13.6) 40 (38.5) 悪心 8 (7.8) 16 (15.4) 頭痛 7 (6.8) 9 (8.7) 嘔吐 1 (1.0) 8 (7.7) 重篤な有害事象※1 4 (3.9) 3 (2.9) 投与中止に至った有害事象※2 5 (4.9) 3 (2.9) - 重篤な有害事象
- 投与中止に至った有害事象
・
プラセボ群:感染性下痢、性器感染、真菌性性器感染、口腔内潰瘍形成、急性熱性好中球性皮膚症、多形紅斑、皮膚病変各1例(1.0%)
・
オテズラ30mg 1日2回投与群:片頭痛、ベーチェット症候群、軟部組織損傷各1例(1.0%)
・
プラセボ群:頭痛、嗜眠、咳嗽、下痢、口腔内潰瘍形成、急性熱性好中球性皮膚症、天疱瘡、皮膚病変、筋骨格系胸痛各1例(1.0%)
・
オテズラ30mg 1日2回投与群:頭痛、ベーチェット症候群、上腹部痛、悪心、嘔吐各1例(1.0%)
プラセボ対照期(日本人集団)における安全性の概要
n(%) プラセボ群
(n=20)オテズラ30mg 1日2回投与群
(n=19)副作用 8(40.0) 11(57.9) 主な副作用(いずれかの群で5%以上発現) 下痢 3 (15.0) 7 (36.8) 悪心 0 (0.0) 2 (10.5) ウイルス性上気道感染 0 (0.0) 1 (5.3) 頭痛 1 (5.0) 1 (5.3) 傾眠 1 (5.0) 1 (5.3) 耳鳴 0 (0.0) 1 (5.3) 動悸 0 (0.0) 1 (5.3) 嘔吐 0 (0.0) 1 (5.3) 腹痛 0 (0.0) 1 (5.3) 腹部膨満 0 (0.0) 1 (5.3) 性器出血 0 (0.0) 1 (5.3) 上気道感染 1 (5.0) 0 (0.0) 気管支炎 1 (5.0) 0 (0.0) 坐骨神経痛 1 (5.0) 0 (0.0) 便秘 1 (5.0) 0 (0.0) 軟便 1 (5.0) 0 (0.0) 発疹 1 (5.0) 0 (0.0) そう痒性皮疹 1 (5.0) 0 (0.0) 倦怠感 1 (5.0) 0 (0.0) 末梢性浮腫 1 (5.0) 0 (0.0) 発熱 1 (5.0) 0 (0.0) 体重増加 1 (5.0) 0 (0.0) 重篤な有害事象※ 0 (0.0) 1 (5.3) - 重篤な有害事象
・
オテズラ30mg 1日2回投与群:片頭痛1例(5.3%)
実薬投与期(全体集団)における安全性の概要
n(%) プラセボ→オテズラ30mg 1日2回投与群
(n=83)オテズラ30mg 1日2回投与群
(n=104)副作用 29 (34.9) 64 (61.5) 主な副作用(いずれかの群で5%以上発現) 下痢 17 (20.5) 41 (39.4) 悪心 6 (7.2) 17 (16.3) 頭痛 7 (8.4) 13 (12.5) 嘔吐 1 (1.2) 8 (7.7) 上腹部痛 0 (0.0) 7 (6.7) 重篤な有害事象※1 7 (8.4) 10 (9.6) 投与中止に至った有害事象※2 3 (3.6) 12 (11.5) - 重篤な有害事象
- 投与中止に至った有害事象
・
プラセボ→オテズラ30mg 1日2回投与群:虫垂炎、帯状疱疹、感染性大腸炎、前庭神経炎、子宮内膜癌、ベーチェット症候群、腟狭窄各1例(1.2%)
・
オテズラ30mg 1日2回投与群:虫垂炎、気管支炎、リンパ節結核、乳癌、片頭痛、ベーチェット症候群、動脈血栓症、急性膵炎、筋炎、関節脱臼、交通事故、軟部組織損傷、脛骨骨折各1例(1.0%)
・
プラセボ→オテズラ30mg 1日2回投与群:前庭神経炎、ベーチェット症候群、腹痛各1例(1.2%)
・
オテズラ30mg 1日2回投与群:悪心2例(1.9%)、非定型マイコバクテリア感染、帯状疱疹、リンパ節結核、乳癌、頭痛、強膜炎、ベーチェット症候群、動脈血栓症、上腹部痛、急性膵炎、嘔吐、筋炎、非心臓性胸痛、緊張性頭痛各1例(1.0%)
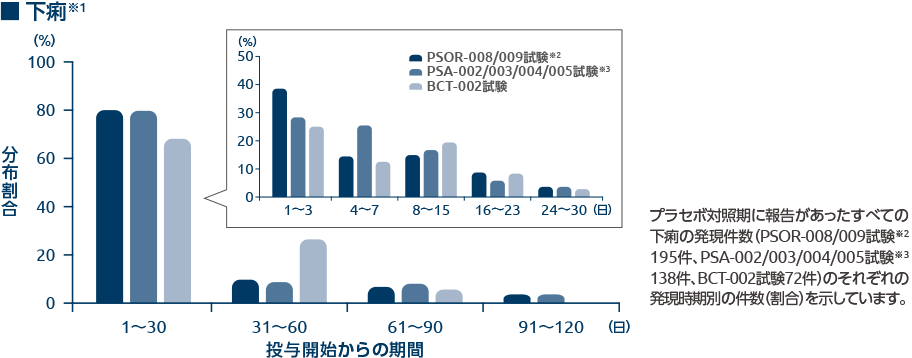
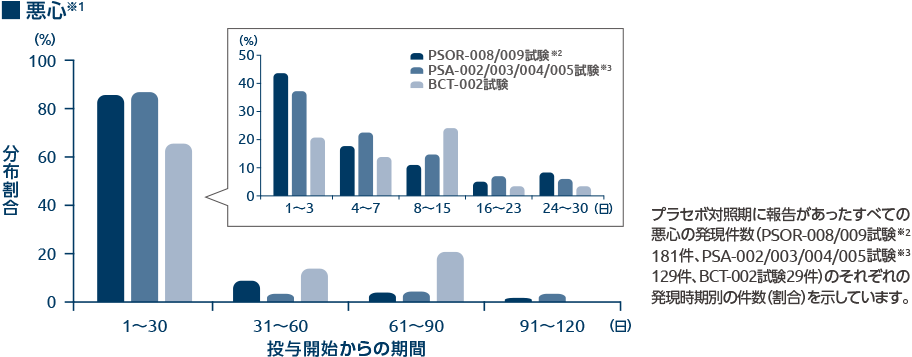
下痢及び悪心の発現時期別の分布割合(有害事象)1、4、5)
下痢、悪心、嘔吐、腹痛等の消化管障害は、PDE4阻害剤使用時にみられる事象であり、本剤の投与中にも発現することが報告されています。
また、市販後に重度の下痢の副作用が報告されています。
オテズラ錠の臨床試験のプラセボ対照期に報告された下痢及び悪心の有害事象の約70~80%は投与開始後30日以内に発現していました。
対処方法
- 本剤の投与開始時は「用法及び用量」を遵守し、漸増投与を行うように指導してください。
- 消化管障害が軽微な場合には、経過観察してください。
- 症状が重篤な場合や症状の改善が認められない場合には、適宜対症療法を実施するとともに、本剤を中止する等の適切な処置を行ってください。
- いずれもプラセボ対照期間(PSOR-008/009試験及びPSA-002/003/004/005試験は0週から16週、BCT-002試験は0週から12週)における本剤30mg 1日2回投与での分布割合を示す。
- 尋常性乾癬#患者を対象とした海外第Ⅲ相臨床試験。
(# 承認された効能又は効果(一部抜粋)は「局所療法で効果不十分な尋常性乾癬」である。) - 乾癬性関節炎患者を対象とした海外第Ⅲ相臨床試験。
4. 効能又は効果
〇局所療法で効果不十分な尋常性乾癬 〇乾癬性関節炎 〇局所療法で効果不十分なベーチェット病による口腔潰瘍
-
References
- CC-10004-BCT-002試験(承認年月:2019年9月、CTD2.7.6.1)(承認時評価資料)
- Hatemi G et al.: N Engl J Med. 381: 1918-1928, 2019
- 厚生労働省:医薬品の適応外使用に係る保険診療上の取扱いについて(平成21年9月15日)
- Amgen社社内資料(承認時評価資料):アプレミラストの海外第Ⅲ相臨床試験2試験の併合解析
- Amgen社社内資料(承認時評価資料):アプレミラストの海外第Ⅲ相臨床試験4試験の安全性併合解析
利益相反: BCT-002試験はAmgen社(旧 Celgene社)の資金提供によりアプレミラストの開発治験として実施され、この結果を報告した論文 2)[Hatemi G et al.: N Engl J Med. 381: 1918-1928, 2019]の著者らには、Amgen社(旧 Celgene社)の社員や指導料等の謝金を受領した者を含みます。