-
試験デザイン
国内第Ⅲ相臨床試験(20200195試験)1)
【目的】
局所療法で効果不十分な日本人掌蹠膿疱症患者にオテズラ30mgを経口投与したときの有効性及び安全性を評価する。
【対象】
スクリーニング開始24週以上前に掌蹠膿疱症と診断され、外用療法で効果不十分かつ、スクリーニング時及びベースライン時にPPPASI総スコアが12以上、かつ手掌又は足底にPPPASI重症度スコアが2以上の膿疱・小水疱を有する日本人患者176例
【方法】
第Ⅲ相多施設共同、ランダム化、層別化、二重盲検、プラセボ対照、並行群間比較試験。本試験はスクリーニング期(最長4週間)、プラセボ対照期(16週間、二重盲検)、実薬投与期(36週間)及び安全性追跡調査期(30日間)の4期で構成された。
プラセボ対照期では、PPPASI総スコア(20以下、21以上30以下、31以上)及び病巣感染の有無を層別因子として、オテズラ30mg 1日2回投与群又はプラセボ群のいずれかに1:1でランダムに割付け、16週間投与した。実薬投与期では、全例をオテズラ30mg 1日2回投与とし、36週間投与した。
オテズラの最終投与後、患者は30日間の追跡調査期に移行した。
【主要評価項目】
投与16週時のPPPASI-50達成率※1(検証的な解析項目)
【副次評価項目】
投与16週時のPPPASI総スコアのベースラインからの変化量、投与16週時のPPSI※2総スコアのベースラインからの変化量、投与16週時のVAS※3スコア(そう痒、疼痛/不快感)のベースラインからの変化量、投与16週時のDLQI※4総スコアのベースラインからの変化量等
【探索的評価項目】
投与16、52週時までのPPPASI-50達成率の推移、投与52週時までのPPPASI-75、PPPASI-90達成率の推移、投与16、52週時までのPPPASI総スコアのベースラインからの変化量の推移、投与16週時までのPPPASIサブスコア(紅斑、膿疱/水疱、鱗屑/落屑)のベースラインからの変化量の推移、投与16、52週時までのPPSI総スコアのベースラインからの変化量の推移、投与52週時までのPPSI-50、PPSI-75達成率の推移、投与52週時までのPGAスコア※50又は1達成率の推移、投与16、52週時までのVASスコア(そう痒、疼痛/不快感)のベースラインからの変化量の推移、投与52週時までのDLQI総スコアのベースラインからの変化量の推移等
【解析計画】
目標症例数は主要評価項目においてプラセボ群に対する差を検出できるよう設計した。主要評価項目は、ランダム化層別因子で調整したCochran-Mantel-Haenszel(CMH)検定を用いて、有意水準0.05(両側)で統計学的検定を実施した。16週までに生じた効果不十分又は有害事象による中止もしくは治験実施計画書で禁止されている薬剤の使用を中間事象(IE)とした。IEの発生は治療失敗として取り扱い、当該被験者をノンレスポンダーとみなすノンレスポンダー補完法(NRI法)を用いて補完し、その他の欠測は多重補完法(MI法)を用いて補完した。CMH型の重みを用いた層間の加重平均により調整済み群間差を求め、CMHに基づく両側p値を算出した。対応する両側95%信頼区間(CI)は正規近似にて求めた。主要評価項目である16週時のPPPASI-50達成率と同様に、2、4、6、8、12週時についても解析した(名目上のp値)。主要評価項目では、主な人口統計学的特性及びベースラインの疾患特性によるサブグループ解析を行った。
副次評価項目は、投与群、評価時期、投与群と評価時期の交互作用及び層別因子を固定効果とし、ベースライン値を共変量とした反復測定の混合モデル(MMRM)を用いて解析した。IEによる治療失敗例では観察されたデータにかかわらずベースライン値をIE後から16週までのデータとして補完したが、その他の理由による欠測データの補完は行わなかった。各群における最小二乗(LS)平均値、標準誤差(SE)及び95%CIと、投与群間におけるLS平均値の差、SE、95%CI及び両側p値をMMRMから算出した。
主要評価項目において統計学的な有意差が認められた場合、固定順序法に従い、各副次評価項目について順に有意水準0.05(両側)で統計学的検定を実施した。これらの検定は途中で統計学的な有意差が認められない又はすべての検定が完了するまで実施することとした。- PPPASI-50達成率:掌蹠膿疱症の重症度評価法であるPPPASI(Palmoplantar Pustulosis Area Severity Index)のスコアがベースラインから50%以上減少(改善)した患者割合。
- PPSI(Palmoplantar Pustulosis Severity Index):掌蹠膿疱症病変の重症度及び治療効果を評価し、グレード判定するために用いられる尺度。
- VAS(Visual Analogue Scale):直近1週間の痒み(又は疼痛/不快感)の程度を左端「全く痒み(又は疼痛/不快感)なし」、右端「考えうる最大の痒み(又は疼痛/不快感)あり」とする100mm VAS上に、患者が印を付け、その位置をスコアとする。
- DLQI(Dermatology Life Quality Index):皮膚疾患に特異的なQOL指標。6つの下位尺度があり、下位尺度スコア又は合計スコアが高いほどQOLが低い。
- PGA(Physician’s Global Assessment):掌蹠膿疱症の症状に対する医師による全般評価指標であり、0(消失)~5(きわめて重度)の6段階で評価する。
4. 効能又は効果(一部抜粋)
○局所療法で効果不十分な掌蹠膿疱症
6. 用法及び用量
通常、成人にはアプレミラストとして以下のとおり経口投与し、6日目以降はアプレミラストとして1回30mgを1日2回、朝夕に経口投与する。
1日目 2日目 3日目 4日目 5日目 6日目以降 朝 朝 夕 朝 夕 朝 夕 朝 夕 朝 夕 10mg 10mg 10mg 10mg 20mg 20mg 20mg 20mg 30mg 30mg 30mg -
患者背景
プラセボ群
(n=88)オテズラ30mg 1日2回投与群
(n=88)年齢(歳)、平均値±SD 56.0±11.4 57.0±11.3 性別、n(%) 男性 16(18.2) 19(21.6) 女性 72(81.8) 69(78.4) 体重(kg)、平均値±SD 61.3±12.1 63.7±14.8 BMI(kg/㎡)、平均値±SD 24.1±4.6 25.0±4.8 掌蹠膿疱症の罹患期間(年)、平均値±SD 6.04±7.47 6.65±7.62 喫煙歴、n(%) 現在喫煙中 42(47.7) 42(47.7) 過去に喫煙 24(27.3) 28(31.8) 喫煙歴なし 22(25.0) 18(20.5) 病巣感染※あり、n(%) 57(64.8) 59(67.0) 病巣感染※の既往歴あり、n(%) 62(70.5) 69(78.4) 掌蹠膿疱症性骨関節炎あり、n(%) 16(18.2) 13(14.8) 生物学的製剤の使用歴あり、n(%) 6(6.8) 6(6.8) PPPASI総スコア、平均値±SD 21.97±8.42 22.13±8.12 PPSI総スコア、平均値±SD 8.0±1.7 8.1±1.6 VASスコア(そう痒)、平均値±SD 51.2±29.6 48.7±29.1 VASスコア(疼痛/不快感)、平均値±SD 45.8±29.9 43.3±29.6 DLQI総スコア、平均値±SD 6.7±4.9 5.7±4.6 PGAスコア、平均値±SD 3.5±0.6 3.5±0.6 ※歯周炎、扁桃炎、副鼻腔炎を含む
-
掌蹠膿疱症による皮膚症状
プラセボ対照期【投与16週時まで】
オテズラ投与16週時のPPPASI-50達成率は、プラセボ群に比べて高い割合でした
投与16週時のPPPASI-50達成率[主要評価項目(検証的な解析結果)]
投与16週時のPPPASI-50達成率は、オテズラ30mg 1日2回投与群で67.8%であり、プラセボ群の35.3%に比べて統計学的に有意に高い値となりました(p<0.0001、Cochran-Mantel-Haenszel検定)。
NRI/MI
Cochran-Mantel-Haenszel検定:PPPASI総スコア(20以下、21以上30以下、31以上)、病巣感染の有無で調整した。投与16週時までのPPPASI-50達成率の推移(探索的評価項目)
オテズラ30mg 1日2回投与群はプラセボ群に比べて、投与2週時よりPPPASI-50達成率が統計学的に有意に高い値となりました(2週:p=0.0001[名目上のp値]、4~12週:p<0.0001[名目上のp値]、16週:p<0.0001、Cochran-Mantel- Haenszel検定)。
n:欠測値補完後のPPPASIー50を達成した患者数 N:総患者数
NRI/MI
Cochran-Mantel-Haenszel検定:PPPASI総スコア(20以下、21以上30以下、31以上)、病巣感染の有無で調整した。投与16週時のサブグループ別PPPASI-50達成率(主要評価項目のサブグループ解析)
投与16週時のPPPASI-50の調整済み群間差は、すべてのサブグループで0以上でした。
n:欠測値補完後のPPPASIー50を達成した患者数 N:総患者数
NRI/MI
群間差はPPPASI総スコア(20以下、21以上30以下、31以上)、病巣感染の有無で調整した。副次評価項目における固定順位法の結果(まとめ)
オテズラ群:オテズラを30mg 1日2回投与
反復測定の混合モデル:投与群、評価時期、投与群と評価時期の交互作用及び層別因子を固定効果とし、ベースライン値を共変量とした。
投与16週時のPPPASI総スコアのベースラインからの変化量(副次評価項目)
投与16週時におけるPPPASI総スコアのベースラインからの変化量(最小二乗平均値)は、オテズラ30mg 1日2回投与群で-12.12であり、プラセボ群の-5.98に比べて統計学的に有意に低下しました(p<0.0001、反復測定の混合モデル)。
投与16週時のPPPASIサブスコア(紅斑、膿疱/水疱、鱗屑/落屑)のベースラインからの変化量とその推移(探索的評価項目)
投与16週時のPPPASIサブスコアのベースラインからの変化量とその推移は以下のとおりでした。
紅斑膿疱/水疱鱗屑/落屑効果不十分又は有害事象による中止、治験実施計画書で禁止されている薬剤の使用による治療失敗例はベースライン値で補完した。
反復測定の混合モデル:投与群、評価時期、投与群と評価時期の交互作用及び層別因子を固定効果とし、ベースライン値を共変量とした。
PPPASI(Palmoplantar Pustulosis Area Severity Index):掌蹠膿疱症病変の重症度及び面積並びに治療効果を評価し、グレード判定するために用いられる尺度。PPPASI-50はベースラインから50%以上の減少(改善)を達成した患者の割合。
実薬投与期【投与52週時まで】
PPPASI-50達成率及びPGAスコア0又は1達成率の推移については、オテズラ投与52週時までの検討を行いました
投与52週時までのPPPASI-50達成率の推移(探索的評価項目)
投与52週時までのPPPASI-50達成率の推移は以下のとおりでした。投与52週時のPPPASI-50達成率はオテズラ30mg 1日2回投与群では72.7%であり、プラセボからオテズラ30mg 1日2回投与に切り替えた群では64.8%でした。
n:欠測値補完後のPPPASI-50 を達成した患者数 N:総患者数
NRI※※本解析は事前に計画されたものではないが、承認審査過程において当局の求めに応じて実施した。
投与52週時までのPGAスコア0又は1達成率の推移(探索的評価項目)
投与52週時までのPGAスコア0又は1達成率の推移は以下のとおりでした。投与52週時のPGAスコア0又は1達成率はオテズラ30mg 1日2回投与群、プラセボからオテズラ30mg 1日2回投与に切り替えた群ともに25.0%でした。
n:欠測値補完後のPGAスコア0又は1を達成した患者数 N:総患者数
LOCF※※本解析は事前に計画されたものではないが、承認審査過程において当局の求めに応じて実施した。
PGA(Physician’s Global Assessment):掌蹠膿疱症の症状に対する医師による全般評価指標であり、0(消失)~5(きわめて重度)の6段階で評価する。
-
掌蹠膿疱症によるそう痒、疼痛/不快感
プラセボ対照期【投与16週時まで】
オテズラ投与16週時のVASスコア変化量は、そう痒及び疼痛/不快感ともに、プラセボ群に比べて改善しました
投与16週時のそう痒VASスコアのベースラインからの変化量とその推移 (副次評価項目・探索的評価項目)投与16週時におけるそう痒VASスコアのベースラインからの変化量(最小二乗平均値)は、オテズラ30mg 1日2回投与群で-17.6であり、プラセボ群の-9.9に比べて統計学的に有意に低くなりました(p=0.0330、反復測定の混合モデル)。
効果不十分又は有害事象による中止、治験実施計画書で禁止されている薬剤の使用による治療失敗例はベースライン値で補完した。
反復測定の混合モデル:投与群、評価時期、投与群と評価時期の交互作用及び層別因子を固定効果とし、ベースライン値を共変量とした。
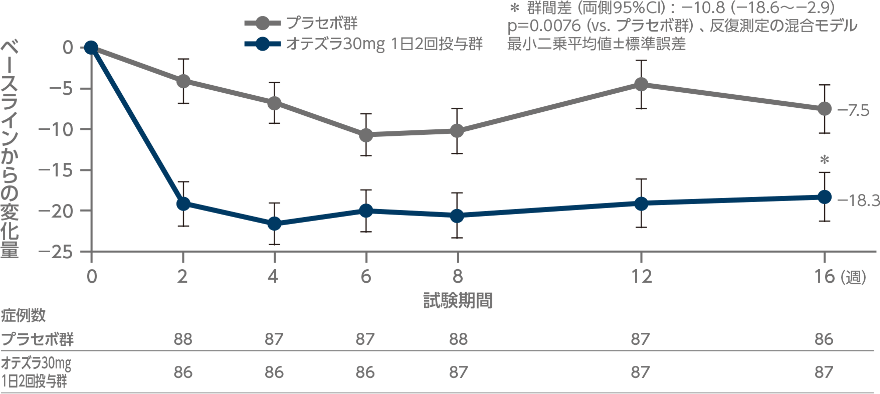
投与16週時の疼痛/不快感VASスコアのベースラインからの変化量とその推移 (副次評価項目・探索的評価項目)
投与16週時における疼痛/不快感VASスコアのベースラインからの変化量(最小二乗平均値)は、オテズラ30mg 1日2回投与群で-18.3であり、プラセボ群の-7.5に比べて統計学的に有意に低くなりました(p=0.0076、反復測定の混合モデル)。
効果不十分又は有害事象による中止、治験実施計画書で禁止されている薬剤の使用による治療失敗例はベースライン値で補完した。
反復測定の混合モデル:投与群、評価時期、投与群と評価時期の交互作用及び層別因子を固定効果とし、ベースライン値を共変量とした。
VAS (Visual Analogue Scale) :直近1週間の痒み(又は疼痛/不快感)の程度を左端「全く痒み(又は疼痛/不快感)なし」、右端「考えうる最大の痒み(又は疼痛/不快感)あり」とする100mm VAS上に、患者が印を付け、その位置をスコアとする。
-
掌蹠膿疱症のDLQI
プラセボ対照期【投与16週時まで】
オテズラ投与16週時のDLQI総スコアのベースラインからの変化量は、プラセボ群に比べて改善しました
投与16週時のDLQI総スコアのベースラインからの変化量(副次評価項目)投与16週時におけるDLQI総スコアのベースラインからの変化量(最小二乗平均値)は、オテズラ30mg 1日2回投与群で-2.3であり、プラセボ群の-0.8に比べて統計学的に有意に低くなりました(p=0.0036、反復測定の複合モデル)。
効果不十分又は有害事象による中止、治験実施計画書で禁止されている薬剤の使用による治療失敗例はベースライン値で補完した。
反復測定の混合モデル:投与群、評価時期、投与群と評価時期の交互作用及び層別因子を固定効果とし、ベースライン値を共変量とした。
DLQI(Dermatology Life Quality Index) :皮膚疾患に特異的なQOL指標。6つの下位尺度があり、下位尺度スコア又は合計スコアが高いほどQOLが低い。
-
安全性
プラセボ対照期【投与16週時まで】
投与16週時までのすべての有害事象は、オテズラ群で71.6%、プラセボ群で48.9%でした
n(%) プラセボ群
(n=88)オテズラ30mg 1日2回投与群
(n=88)すべての有害事象 43(48.9) 63(71.6) すべての治療関連有害事象 8(9.1) 42(47.7) 重篤な有害事象※1 1(1.1) 1(1.1) 投与中止に至った有害事象※2 1(1.1) 1(1.1) 死亡に至った有害事象 0 0 主な有害事象(いずれかの群で10%以上) 下痢 3(3.4) 17(19.3) 軟便 1(1.1) 15(17.0) 頭痛 2(2.3) 10(11.4) 悪心 1(1.1) 10(11.4) - 重篤な有害事象
・プラセボ群:仮性動脈瘤感染及び急性心筋梗塞1例(1.1%)
・オテズラ30mg 1日2回投与群:小脳出血1例(1.1%) - 投与中止に至った有害事象
・プラセボ群:状態悪化1例(1.1%)
・オテズラ30mg 1日2回投与群:下痢1例(1.1%)
実薬投与期【投与52週時まで】
投与52週時までのすべての有害事象は、オテズラ投与例で85.1%でした
n(%) オテズラ30mg 1日2回投与群
(n=174)※1すべての有害事象 148(85.1) すべての治療関連有害事象 73(42.0) 重篤な有害事象※2 9(5.2) 投与中止に至った有害事象※3 5(2.9) 死亡に至った有害事象 0 主な有害事象(10%以上) 下痢 31(17.8) 上咽頭炎 28(16.1) 悪心 23(13.2) 軟便 22(12.6) 頭痛 19(10.9) COVID-19 18(10.3) - 0週にオテズラ30mg 1日2回投与群であった患者又は16週にプラセボ群からオテズラ30mg 1日2回投与に切り替えた患者
- 重篤な有害事象
白内障2例(1.1%)、脳梗塞、十二指腸穿孔、胆石症、変形性関節症、腎盂腎炎、急性腎盂腎炎、ウイルス感染、小脳出血各1例(0.6%) - 投与中止に至った有害事象
下痢、掌蹠膿疱症、関節痛、変形性関節症、体重減少各1例(0.6%)
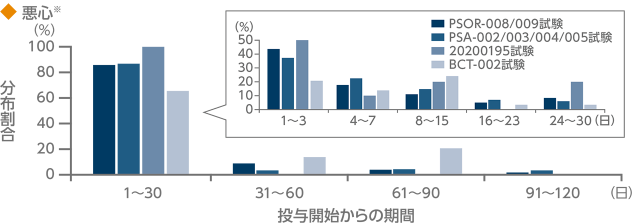
下痢及び悪心の発現時期別の分布割合(有害事象)2-5)
掌蹠膿疱症患者を対象とした国内第Ⅲ相臨床試験(20200195試験)において報告された多くの下痢及び悪心の
有害事象は投与開始後2週間以内に発現し、発現割合は経時的に減少しました。
下痢2-5)
プラセボ対照期間に報告があったすべての下痢の発現件数(PSOR-008/009試験195件、PSA-002/003/004/005試験138件、20200195試験20件、BCT-002試験72件)のそれぞれの発現時期別の件数(割合)を示しています。
悪心2-5)
プラセボ対照期間に報告があったすべての悪心の発現件数(PSOR-008/009試験181件、PSA-002/003/004/005試験129件、20200195試験10件、BCT-002試験29件)のそれぞれの発現時期別の件数(割合)を示しています。
- いずれもプラセボ対照期間(PSOR-008/009試験、PSA-002/003/004/005試験及び20200195試験は0週から16週、BCT-002試験は0週から12週)における本剤30mg 1日2回投与での分布割合
対処方法6)
- 本剤の投与開始時は「用法及び用量」を遵守し、漸増投与を行うように指導してください。
- 症状が重篤な場合や症状の改善が認められない場合には、適宜対症療法を実施するとともに、本剤を中止する等の適切な処置を行ってください。
- 重篤な有害事象
-
References
- 20200195試験 (承認年月:2025年3月、CTD2.7.6.2) (承認時評価資料)
- Amgen社社内資料(承認時評価資料):アプレミラストの海外第III相臨床試験2試験の併合解析
- Amgen社社内資料(承認時評価資料):アプレミラストの海外第III相臨床試験4試験の安全性併合解析
- 20200195試験(承認年月:2025年3月、CTD2.7.6.2)(承認時評価資料)
- CC-10004-BCT-002試験(承認年月:2019年9月、CTD2.7.6.1)(承認時評価資料)
- オテズラ錠適正使用ガイド2025年3月作成









![図:投与16週時のPPPASI-50達成率[主要評価項目(検証的な解析結果)]](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/otezla/ppp-efficacy-trial/otezla_s1-8)