-
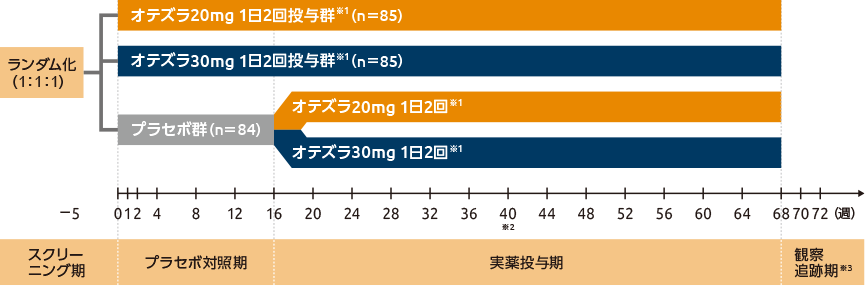
試験デザイン
国内後期第Ⅱ相臨床試験(PSOR-011試験:FREEDOM試験)1,2)(ブリッジング試験)
オテズラ20mg 1日2回投与は本邦未承認の用法・用量だが、その安全性の結果については安全性に関わる重要な情報として掲載した。有効性についてはオテズラ30mg 1日2回投与時の結果のみ掲載した。
【目的】
日本人の中等症~重症の尋常性乾癬患者にオテズラ2用量を経口投与したときの有効性及び安全性を評価する。
【対象】
乾癬病変の体表面積(BSA)10%以上及びPASIスコア12以上で、局所療法が不適と判断された、又は、局所療法で適切にコントロール/治療できない中等症~重症の尋常性乾癬で20歳以上の日本人患者254例
【方法】
後期第Ⅱ相多施設共同、ランダム化、二重盲検、プラセボ対照試験。本試験は、スクリーニング期、プラセボ対照期、実薬投与期、観察追跡期で構成された。プラセボ対照期はオテズラ20mg 1日2回投与群、30mg 1日2回投与群、又はプラセボ群に1:1:1でランダムに割付け、16週間投与した。16週時にプラセボ群の患者を盲検下でオテズラ20mg 1日2回投与、30mg 1日2回投与に1:1で再割付けし、更に52週間の実薬投与を行った。
※1 オテズラ投与開始時は、最初の6日間にオテズラを1日10mgずつ漸増投与。
※2 40週時にすべてのノンレスポンダー(<PASI-50)は、局所療法及び/又は光線療法の併用が可能。
※3 試験治療を完遂又は中止したすべての患者は4週間の観察追跡期に移行。
【主要評価項目】
投与16週時のPASI-75達成率※4
【副次評価項目】
投与16週時のDLQI合計スコア※5のベースラインからの変化量など
【探索的評価項目】
投与68週時のDLQI合計スコアのベースラインからの変化量など
【解析計画】
目標症例数は主要評価項目(投与16週時のPASI-75達成率)においてプラセボ群に対する差を検出できるよう設計した。
主要評価項目及び副次評価項目における各オテズラ群とプラセボ群との統計学的な比較は、階層的に主要評価項目での比較に続き、上記副次評価項目(記載順)の順序で実施した。各項目の統計学的比較において、2つの対比較(オテズラ20mg 1日2回投与群又は30mg 1日2回投与群とプラセボ群)でp<0.05(両側)の場合は、両比較とも有意とみなし、次の評価項目について両方の比較を有意水準0.05で検定した。2つの対比較のうち一方がp<0.025(両側)でもう一方がp≧0.05(両側)の場合は、p<0.025であった比較のみ有意とみなし、次の副次評価項目は有意であった対比較のみを有意水準0.025で検定した。いずれの対比較でもp≧0.05(両側)の場合は有意とはみなさず、それ以降の副次評価項目の統計学的比較は行わなかった。※4 PASI-75達成率:乾癬の代表的な重症度評価法であるPASI (Psoriasis Area and Severity Index)のスコアがベースラインから75%以上減少(改善)した患者割合
※5 DLQI (Dermatology Life Quality Index):皮膚疾患に特異的なQOL指標。6つの下位尺度があり、下位尺度スコア又は合計スコアが高いほどQOLが低いa)
a)Finlay AY et al.: Clin Exp Dermatol. 19:210-216, 1994
4. 効能又は効果(一部抜粋)
○局所療法で効果不十分な尋常性乾癬 ○乾癬性関節炎
6. 用法及び用量
通常、成人にはアプレミラストとして以下のとおり経口投与し、6日目以降はアプレミラストとして1回30mgを1日2回、朝夕に経口投与する。
1日目 2日目 3日目 4日目 5日目 6日目以降 朝 朝 夕 朝 夕 朝 夕 朝 夕 朝 夕 10mg 10mg 10mg 10mg 20mg 20mg 20mg 20mg 30mg 30mg 30mg -
患者背景
プラセボ群
(n=84)オテズラ20mg 1日2回投与群
(n=85)オテズラ30mg 1日2回投与群
(n=85)年齢(歳)、平均値±SD 48.3±12.0 52.2±12.5 51.7±12.7 性別、n(%) 男性 62(73.8) 69(81.2) 71(83.5) 女性 22(26.2) 16(18.8) 14(16.5) 体重(kg)、平均値±SD 68.5±13.8 71.2±12.9 70.1±13.0 BMI(kg/㎡)、平均値±SD 24.7±4.7 25.8±4.2 24.9±3.7 尋常性乾癬の罹病期間(年)、平均値±SD 12.4±9.4 12.6±10.6 13.9±9.2 PASIスコア、平均値±SD 19.9±8.9 22.1±9.6 21.6±8.9 乾癬病変のBSA(%)、平均値±SD 28.0±15.4 32.0±17.5 30.7±16.1 -
有効性
日本人の尋常性乾癬患者においても、投与16週時のPASI-75達成率はプラセボ群に比べオテズラ群で有意に高く、皮膚症状を改善しました
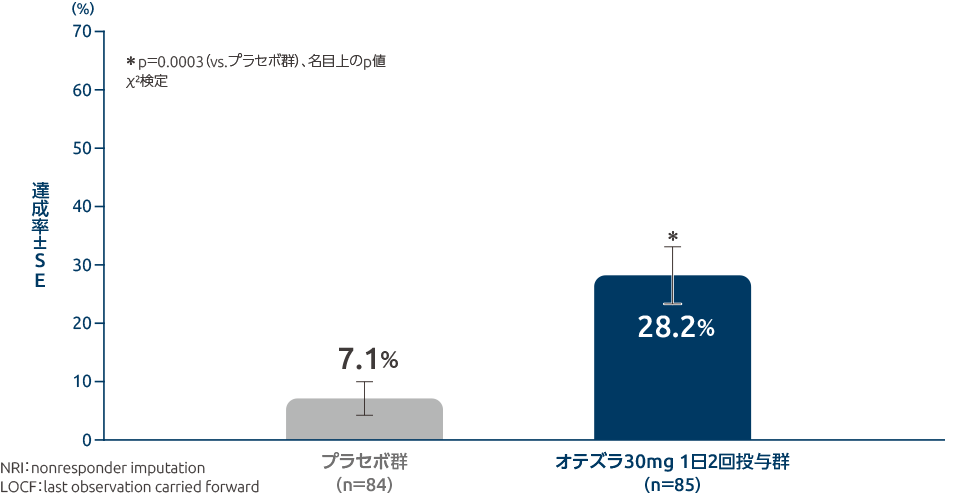
投与16週時のPASI-75達成率(主要評価項目)
投与16週時のPASI-75達成率は、オテズラ30mg 1日2回投与群では28.2%であり、プラセボ群の7.1%に比べ統計学的に有意に高い値となりました(p=0.0003、名目上のp値、χ2検定)。
投与16・68週時のDLQI合計スコアのベースラインからの変化量
(16週時:副次評価項目、68週時:探索的評価項目)
投与16週時のDLQI合計スコアのベースラインからの平均変化量(SD)はオテズラ30mg 1日2回投与群-2.2点(5.0)であり、プラセボ群の1.3点(5.7)に比べオテズラ投与群で有意な減少が認められました(p<0.0001、名目上のp値、χ2 検定)。
プラセボ対照期(16週時)mlTT(LOCF) 実薬投与期(68週時) プラセボ群
(n=84)オテズラ30mg
1日2回投与群
(n=85)プラセボ/
オテズラ30mg
1日2回投与群
(n=35)オテズラ30mg
1日2回投与群
(n=85)DLQI合計スコア
のベースラインか
らの変化量(点)、
平均値±SD1.3±5.7 −2.2±5.0* −1.9±5.7 −3.3±5.4 *p<0.0001(vs.プラセボ群)、名目上のp値、χ2検定
-
安全性
プラセボ対照期(0~16週)における安全性の概要
n(%) プラセボ群
(n=84)オテズラ20mg
1日2回投与群
(n=85)オテズラ30mg
1日2回投与群
(n=85)
副作用 8 (9.5) 18 (21.2) 25 (29.4) 主な副作用(いずれかの群で5%以上) 下痢 1 (1.2) 4 (4.7) 7 (8.2) 腹部不快感 0 (0) 0 (0) 6 (7.1) 重篤な有害事象※1 0 (0) 4 (4.7) 0 (0) 投与中止に至った有害事象※2 4 (4.8) 10 (11.8) 6 (7.1) 死亡に至った有害事象 0 (0) 0 (0) 0 (0) - 重篤な有害事象
・オテズラ20mg 1日2回投与群:細菌性関節炎、脳出血、冠動脈狭窄、胆石症各1例(1.2%) - いずれかの群で2例以上に認められた投与中止に至った有害事象
・プラセボ群:乾癬2例(2.4%)
・オテズラ20mg 1日2回投与群:乾癬3例(3.5%)
・オテズラ30mg 1日2回投与群:乾癬4例(4.7%)
オテズラ投与期(0~68週)における安全性の概要
n(%) オテズラ20mg
1日2回投与群※1
(n=121)オテズラ30mg
1日2回投与群※2
(n=120)副作用 34 (28.1) 37 (30.8) 主な副作用(いずれかの群で5%以上) 下痢 5 (4.1) 11 (9.2) 腹部不快感 2 (1.7) 7 (5.8) 重篤な有害事象※3 11 (9.1) 2 (1.7) 投与中止に至った有害事象※4 19 (15.7) 10 (8.3) 死亡に至った有害事象※5 1 (0.8) 0 (0) - 0週にオテズラ20mg 1日2回投与群であった患者又は16週にプラセボ群からオテズラ20mg 1日2回投与群に再割付された患者
- 0週にオテズラ30mg 1日2回投与群であった患者又は16週にプラセボ群からオテズラ30mg 1日2回投与群に再割付された患者
- 重篤な有害事象
・オテズラ20mg 1日2回投与群:胆石症2例(1.7%)、細菌性関節炎、肺炎、結腸癌、転移性結腸癌、転移性肺癌、糖尿病、
脳出血、うっ血性心不全、冠動脈狭窄、気胸、胆管結石、椎間板突出、腎梗塞各1例(0.8%)
・オテズラ30mg 1日2回投与群:歯周炎、眼圧上昇各1例(0.8%) - 2例以上に認められた投与中止に至った有害事象
・オテズラ20mg 1日2回投与群:乾癬5例(4.1%)
・オテズラ30mg 1日2回投与群:乾癬5例(4.2%)、下痢2例(1.7%) - 死亡に至った有害事象
・オテズラ20mg 1日2回投与群:遠隔転移を伴う肺癌1例(0.8%)
4. 効能又は効果(一部抜粋)
○局所療法で効果不十分な尋常性乾癬
6. 用法及び用量
通常、成人にはアプレミラストとして以下のとおり経口投与し、6日目以降はアプレミラストとして1回30mgを1日2回、朝夕に経口投与する。
1日目 2日目 3日目 4日目 5日目 6日目以降 朝 朝 夕 朝 夕 朝 夕 朝 夕 朝 夕 10mg 10mg 10mg 10mg 20mg 20mg 20mg 20mg 30mg 30mg 30mg - 重篤な有害事象
-
References
- CC-10004-PSOR-011試験(承認年月:2016年12月、CTD2.7.6.23)(承認時評価資料)
- Ohtsuki M et al.:J Dermatol. 44:873–884, 2017
利益相反:PSOR-011試験はAmgen社(旧 Celgene社)の資金提供によりアプレミラストの開発治験として実施され、この結果を報告した論文2)[Ohtsuki M et al.: J Dermatol. 44:873–884, 2017]の著者らには、 Amgen社(旧 Celgene社)の社員や指導料などの謝金を受領した者を含みます。