-
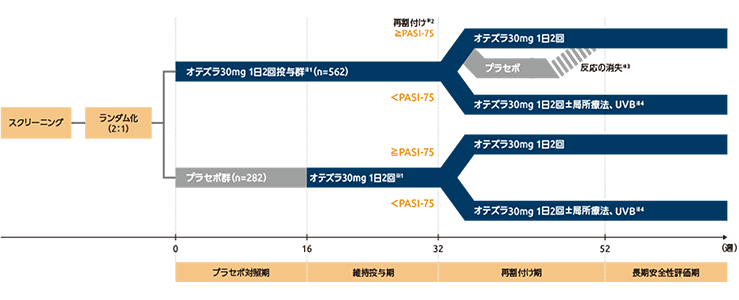
試験デザイン
海外第Ⅲ相臨床試験(PSOR-008試験:ESTEEM-1 試験)1-5)(海外データ)
【目的】
中等症~重症の尋常性乾癬患者にオテズラ30mgを1日2回経口投与したときの有効性及び安全性を、プラセボを対照として評価する。
【対象】
BSA10%以上、PASIスコア12以上、sPGAスコア3以上の中等症~重症の18歳以上の尋常性乾癬患者844例
【方法】
第Ⅲ相多施設共同、ランダム化、二重盲検、プラセボ対照試験。本試験はプラセボ対照期(16週間、ランダム化、二重盲検)、維持投与期(16週間、二重盲検)、再割付け期(20週間、ランダム化、二重盲検)及び長期安全性評価期(208週間、非盲検)の4期で構成された。
プラセボ対照期では、オテズラ30mg 1日2回投与群又はプラセボ群に2:1でランダムに割付け、16週間投与した。プラセボ群では16週時に盲検下でオテズラ30mg 1日2回投与に切り替え、オテズラ30mg 1日2回投与群では同用量を盲検下で32週まで継続した(維持投与期)。32~52週の治療中の評価は上記のとおり実施し、52週時に長期安全性評価期に移行したすべての患者はオテズラ30mgを1日2回で最長4年間投与した。
- オテズラの投与開始時又はプラセボからオテズラへの投与切り替え時は、最初の6日間にオテズラを1日あたり10mgずつ漸増投与。
- プラセボ対照期のオテズラ30mg 1日2回投与群のうち32週時にPASI-75を達成した患者をオテズラ30mg 1日2回又はプラセボ投与に再割付け。
プラセボ対照期のオテズラ30mg 1日2回投与群のうちPASI-75未達成患者、及びプラセボ対照期のプラセボ群の患者は再割付けせず、52週までオテズラ30mg 1日2回投与を継続。 - プラセボ群に再割付けされPASI-75が消失した患者は、オテズラ30mg 1日2回投与を再開。
- 32週時のPASI-75未達成患者は、治験担当医師の判断により、局所療法や紫外線B波(UVB)の光線療法の併用が可能。
【主要評価項目】
投与16週時のPASI-75達成率(検証的な解析項目)
【副次評価項目】
投与16週時のsPGA達成率、投与16週時の乾癬病変のBSA(%)のベースラインからの変化率、投与16週時のPASIスコアのベースラインからの変化率、 投与16週時のPASI-50達成率、投与16週時のそう痒VASスコアのベースラインからの変化量、投与16週時のDLQI合計スコアのベースラインからの変化量等
【探索的評価項目】
投与16週時のNAPSIスコア※5のベースラインからの変化率、投与16週時のScPGAスコア0/1達成率※6、投与24、32週時のPASIスコアの変化率、投与24、32週時のそう痒VASスコアのベースラインからの変化量、投与24、32週時のDLQI合計スコアのベースラインからの変化量等
【解析計画】
目標症例数は主要評価項目(投与16週時のPASI-75達成率)においてプラセボ群に対する差を検出できるよう設計した。
有効性の解析では、ステップダウン法を用いて統計学的に比較を行った。主要評価項目に続き、副次評価項目(上記記載順)、さらに投与16週時の探索的評価項目(上記記載順)の順に、ある評価項目がp<0.05(両側)で、かつその前の評価項目すべてが統計学的に有意(p<0.05)であった場合のみ、当該項目は統計学的に有意であるとし、ステップダウン法の階層基準を満たさなかった評価項目でp<0.05(両側)であった場合は、未調整のp値(名目上のp値)として記載した。
- NAPSI(Nail Psoriasis Severity Index)スコア:左右の指の中で最も乾癬の症状が重い爪(評価爪)の重症度を評価する指標。合計スコアが高いほど爪乾癬の重症度が高いことを示す。
- ScPGAスコア0/1達成率:頭皮の乾癬を有する患者において、頭皮に対する医師による全般評価指標であるScPGA(Scalp Physician Global Assessment)スコアが0(消失)又は1(ほぼ消失)に改善した患者の割合。
4. 効能又は効果(一部抜粋)
○局所療法で効果不十分な尋常性乾癬 ○乾癬性関節炎
6. 用法及び用量
通常、成人にはアプレミラストとして以下のとおり経口投与し、6日目以降はアプレミラストとして1回30mgを1日2回、朝夕に経口投与する。
1日目 2日目 3日目 4日目 5日目 6日目以降 朝 朝 夕 朝 夕 朝 夕 朝 夕 朝 夕 10mg 10mg 10mg 10mg 20mg 20mg 20mg 20mg 30mg 30mg 30mg -
患者背景
中等症~重症の尋常性乾癬患者を対象とした海外第Ⅲ相臨床試験
プラセボ群
(n=282)オテズラ30mg 1日2回投与群
(n=562)年齢(歳)、平均値±SD 46.5±12.7 45.8±13.1 性別、n(%) 男性 194(68.8) 379(67.4) 女性 88(31.2) 183(32.6) 体重(kg)、平均値±SD 93.7±23.2 93.2±21.4 BMI(kg/㎡)、平均値±SD 31.3±7.4 31.2±6.7 尋常性乾癬の罹病期間(年)、平均値±SD 18.7±12.4 19.8±13.0 乾癬性関節炎の既往歴・合併症あり、n(%) 50(17.7) 123(21.9) PASIスコア、平均値±SD 19.4±7.4 18.7±7.2 乾癬病変のBSA(%)、平均値±SD 25.3±14.6 24.4±14.7 -
皮疹
オテズラ錠の投与16週時にPASIスコアは改善しました
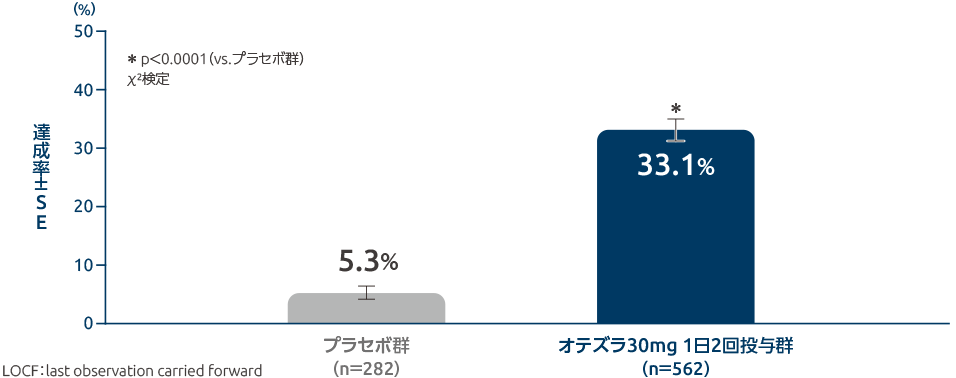
投与16週時のPASI-75達成率[主要評価項目(検証的な解析結果)](海外データ)
投与16週時のPASI-75達成率は、オテズラ30mg 1日2回投与群では33.1%であり、プラセボ群の5.3%に比べ統計学的に有意に改善しました(p<0.0001、χ2検定)。
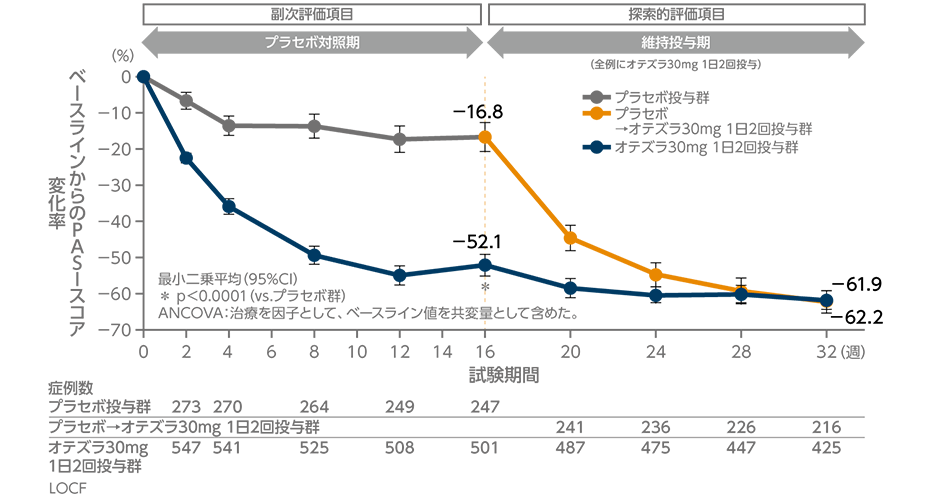
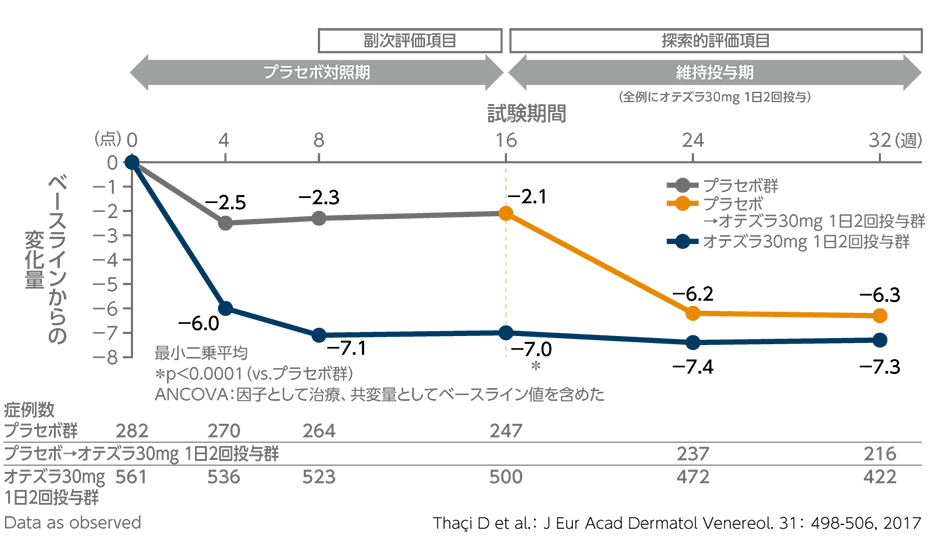
投与32週時までのPASIスコア変化率の推移
(投与16週時:副次評価項目、投与24・32週時:探索的評価項目)(海外データ)
オテズラ30mg 1日2回投与群の投与16週時のPASIスコア変化率(最小二乗平均)は、プラセボ群に比べ有意に低下しました(p<0.0001、ANCOVA)。なお、32週時では、-61.9%であり、16週時以降にオテズラ30mg 1日2回投与に切り替えた群は-62.2%でした。
PASIスコアがベースラインから75%以上減少(改善)した患者割合をPASI-75達成率という。
-
かゆみ
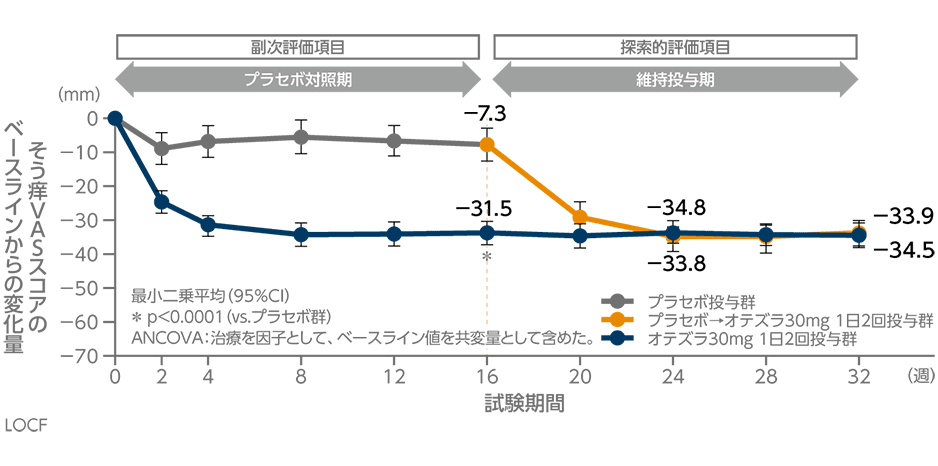
参考情報 投与32週時までのそう痒VASスコアのベースラインからの変化量の推移
(投与16週時:副次評価項目、投与24・32週時:探索的評価項目)(海外データ)
オテズラ30mg 1日2回投与群の投与16週時のそう痒VASスコアの変化量(最小二乗平均)は-31.5mmでした。なお、32週時では-34.5mmであり、16週時以降にオテズラ30mg 1日2回投与に切り替えた群は-33.9mmでした。
-
頭皮の乾癬・爪乾癬
オテズラ錠の投与16週時に治療困難な部位である頭皮の乾癬及び爪乾癬を評価する指標(ScPGAスコア及びNAPSIスコア)は改善しました
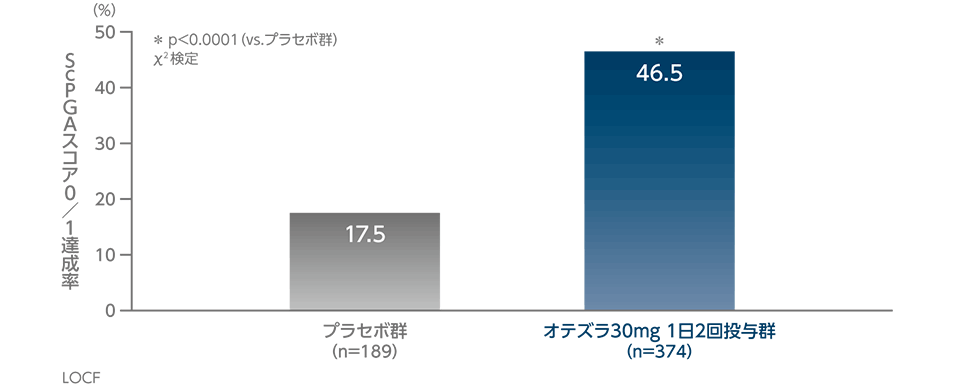
投与16週時のScPGAスコア0/1達成率(探索的評価項目)(海外データ)
ベースラインで中等度又は重度(ScPGAスコア≧3)の頭皮の乾癬を有していた患者における投与16週時のScPGAスコア0/1達成率は、オテズラ30mg 1日2回投与群では46.5%であり、プラセボ群17.5%に比べ統計学的に有意に高い値となりました(p<0.0001、χ2検定)。
ScPGA(Scalp Physician Global Assessment):頭皮の乾癬を評価する指標。0(消失)~5(きわめて重度)の6段階で評価する。
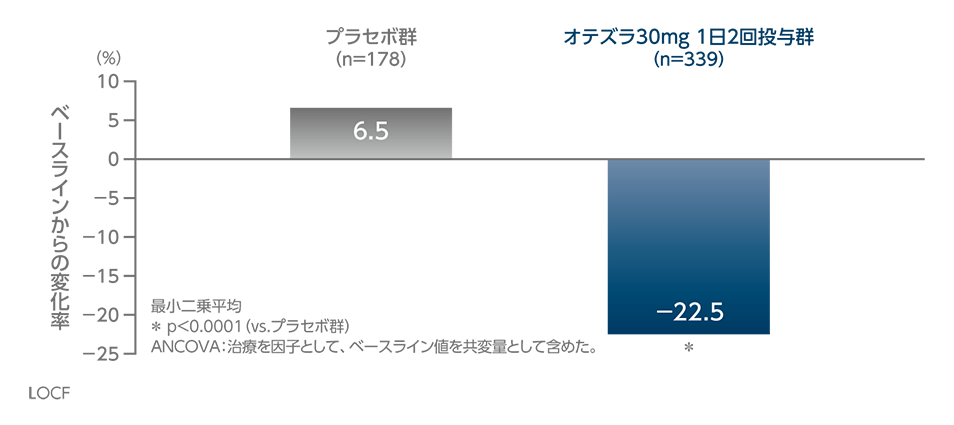
投与16週時のNAPSIスコアのベースラインからの変化率(探索的評価項目)(海外データ)
ベースラインで爪乾癬を有していた患者における投与16週時のNAPSIスコアのベースラインからの変化率(最小二乗平均)は、オテズラ30mg 1日2回投与群で-22.5%であり、プラセボ群の6.5%に比べ統計学的に有意に低くなりました(p<0.0001、ANCOVA)。
NAPSI (Nail Psoriasis Severity Index):左右の指の中で最も乾癬の症状が重い爪(評価爪)の重症度を評価する指標。合計スコアが高いほど爪乾癬の重症度が高いことを示す。
-
DLQI
投与32週時までのDLQI合計スコアの変化量の推移
(16週時:副次評価項目、24・32週時:探索的評価項目)(海外データ)
オテズラ30mg 1日2回投与群の16週時のDLQI合計スコアの変化量(最小二乗平均)は-7.0点と、プラセボ群の-2.1点に比べ統計学的に有意に低くなりました(p<0.0001、ANCOVA)。なお、32週時では、-7.3点であり、16週時以降にオテズラ30mg 1日2回投与に切り替えた群は-6.3点でした。
DLQI (Dermatology Life Quality Index):皮膚疾患に特異的なQOL指標。6つの下位尺度があり、下位尺度スコア又は合計スコアが高いほどQOLが低い。
-
安全性
投与16週時及び52週時までの副作用発現率は以下の通りで、主な副作用は下痢、悪心でした
プラセボ対照期(0~16週)の安全性の概要
n(%) プラセボ群
(n=282)オテズラ30mg
1日2回投与群
(n=560)副作用 58 (20.6) 224 (40.0) 主な副作用(いずれかの群で5%以上) 下痢 13 (4.6) 92 (16.4) 悪心 15 (5.3) 78 (13.9) 重篤な有害事象※1 8 (2.8) 12 (2.1) 投与中止に至った有害事象※2 9 (3.2) 29 (5.2) 死亡に至った有害事象※3 1 (0.4) 1 (0.2) - 重篤な有害事象
・プラセボ群:肺炎、鼠径ヘルニア、クロストリジウム・ディフィシレ大腸炎、肛門癌、自殺既遂、血中ビリルビン増加、失神、上室性頻脈、心筋梗塞、胆嚢炎各1例(0.4%)
・オテズラ30mg 1日2回投与群:肺炎、鼠径ヘルニア、小球性貧血、一過性脳虚血発作、急性心筋梗塞、心不全、起立性低血圧、末梢動脈閉塞性疾患、慢性閉塞性肺疾患、腹痛、蕁麻疹、発熱、心拍数増加、脳振盪、多発性外傷、交通事故各1例(0.2%) - いずれかの群で3例以上に認められた投与中止に至った有害事象
・オテズラ30mg 1日2回投与群:悪心10例(1.8%)、下痢7例(1.3%)、頭痛、消化不良各3例(0.5%) - 死亡に至った有害事象
・プラセボ群:自殺既遂1例(0.4%)
・オテズラ30mg 1日2回投与群:心不全1例(0.2%)
オテズラを投与された集団(0~52週)における安全性の概要
n(%) オテズラ30mg
1日2回投与群※1
(n=804)副作用 340 (42.3) 主な副作用(5%以上) 下痢 128 (15.9) 悪心 104 (12.9) 重篤な有害事象※2 34 (4.2) 投与中止に至った有害事象※3 59 (7.3) 死亡に至った有害事象※4 1 (0.1) - 0週にオテズラ30mg 1日2回投与群であった患者又は16週にプラセボ群からオテズラ30mg 1日2回投与に切り替えた患者
- 2例以上に認められた重篤な有害事象
冠動脈疾患、腎結石症各3例(0.4%)、尿路感染、急性心筋梗塞、慢性閉塞性肺疾患各2例(0.2%) - 3例以上に認められた投与中止に至った有害事象
悪心14例(1.7%)、下痢10例(1.2%)、乾癬6例(0.7%)、嘔吐4例(0.5%)、頭痛、緊張性頭痛、消化不良各3例(0.4%) - 死亡に至った有害事象
心不全1例(0.1%)
- 重篤な有害事象
-
References
- CC-10004-PSOR-008試験(承認年月:2016年12月、CTD2.7.6.20)(承認時評価資料)
- Papp K et al.:J Am Acad Dermatol. 73:37-49, 2015
- Rich P et al.:J Am Acad Dermatol. 74:134-142, 2016
- Sobell JM et al.: Acta Derm Venereol. 96: 514-520, 2016
- Thaçi D et al.: J Eur Acad Dermatol Venereol. 31: 498-506, 2017
利益相反:PSOR-008試験(ESTEEM-1)はAmgen社(旧 Celgene社)の資金提供によりアプレミラストの開発治験として実施され、この結果を報告した論文2)[Papp K et al.: J Am Acad Dermatol. 73: 37-49, 2015]、3)[Rich P et al.: J Am Acad Dermatol. 74: 134-142, 2016]、4)[Sobell JM et al.: Acta Derm Venereol. 96: 514-520, 2016]、5)[Thaçi D et al.: J Eur Acad Dermatol Venereol. 31: 498-506, 2017]の著者らには、Amgen社(旧 Celgene社)の社員や指導料などの謝金を受領した者を含みます。