高血糖
11.1.2 高血糖(1.9%)、糖尿病(3.8%)
【解説】
本剤はIGF-1受容体を阻害することから、IGF-1による成長ホルモン分泌に対する負のフィードバックを阻害し、成長ホルモンの分泌が亢進することでグルコース及びインスリン濃度の増加をもたらす可能性があります1)。
臨床試験における高血糖の発現状況2)
国内第Ⅲ相臨床試験(HZNP-TEP-303試験)において、高血糖に関連する有害事象は、二重遮蔽投与期間で本剤群22.2%(6/27例)、プラセボ群3.7%(1/27例)でした。本剤群で認められた高血糖に関連
する有害事象は全て非重篤であり、重症度は軽度又は中等度でした。投与中止に至った有害事象は認められませんでした。
オープンラベル投与期間では、初回治療の患者の8.7%(2/23例)に高血糖に関連する有害事象が認められました。いずれの事象も非重篤かつ軽度であり、投与中止には至りませんでした。
国内第Ⅲ相臨床試験(HZNP-TEP-303試験)での高血糖に関連する有害事象※1(二重遮蔽投与期間)
| 症例 | 関連する病歴※2 | 高血糖関連 有害事象 |
発症時期 | 治療の有無 |
|---|---|---|---|---|
| 本剤群 | ||||
| 症例1 | 糖尿病 | 糖尿病 | Day22 | 治療有り※3 |
| 症例2 | 2型糖尿病 | 高血糖 | Day85 | 治療有り※3 |
| 症例3 | 2型糖尿病 | 糖尿病 | Day86 | 治療無し |
| 症例4 | - | 血中ブドウ糖増加 | Day127 | 治療無し |
| 症例5 | - | 高血糖 | Day43 | 治療無し |
| 症例6 | - | 耐糖能障害 | Day85 | 治療無し |
| プラセボ群 | ||||
| 症例7 | - | 血中ブドウ糖増加 | Day43 - 162 | 治療無し |
MedDRA Version 26.0
※1 MedDRA SMQ「高血圧/糖尿病の発症」(狭域)に該当する有害事象
※2 MedDRA SMQ「高血圧/糖尿病の発症」(狭域)に該当する病歴
※3 追加の血糖降下薬による治療
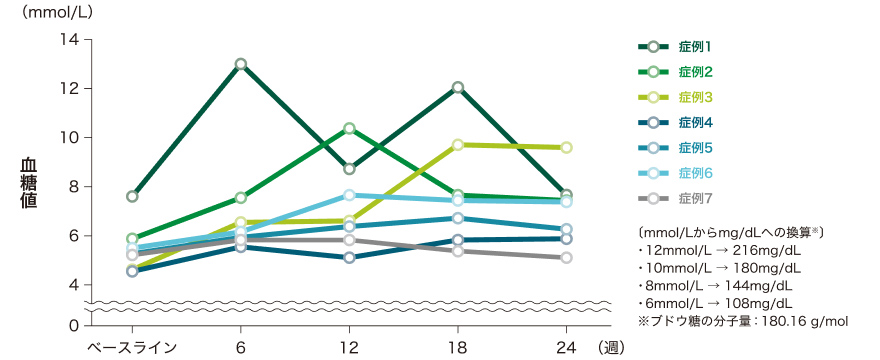
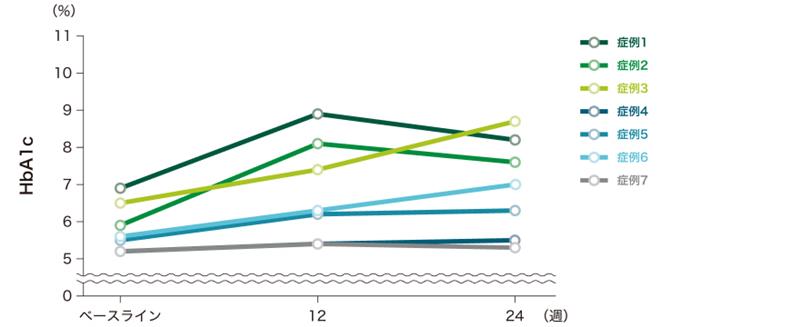
各症例の検査値(空腹時血糖・HbA1c(glycated hemoglobin))の推移は以下のとおりです。
空腹時血糖値の推移
HbA1cの推移
海外第Ⅱ相試験(TED01RV試験)、海外第Ⅲ相試験(HZNP-TEP-301試験)、海外第Ⅲ相継続試験(HZNPTEP-302試験)の併合解析において、二重遮蔽化集団では、高血糖に関連する有害事象は、本剤群9.5%(8/84例)、プラセボ群1.2%(1/86例)でした。本剤群で認められた高血糖に関連する有害事象は全て非重篤であり、重症度は軽度又は中等度でした。投与中止に至った有害事象は認められませんでしたが、1例で投与が一時的に中断されました。HZNP-TEP-302試験集団では、初回治療の患者3例に高血糖に関連する有害事象が発現しましたが、いずれも非重篤かつ軽度又は中等度でした。
なお、糖尿病性ケトアシドーシスや高浸透圧性高血糖状態に至った症例が報告されています。
対処法 2,3)
- 本剤投与前に患者の血糖値をご確認ください。糖尿病患者又は耐糖能異常のある方においては、本剤の投与開始前に、血糖値を適切にコントロールしてください。
- 定期的に血糖値や尿糖、HbA1cの測定を行ってください。
- 口渇や多飲等の症状の発現に注意し、必要に応じて、インスリンを含む糖尿病用薬の投与を行う、又は本剤の投与を中止する等、適切な処置を行ってください。
炎症性腸疾患(IBD)
【解説】
IBDの病因は不明ですが、活動期のIBD患者においてIGF-1の血清及び胃腸濃度の低下が認められています。本剤によるIGF-1R阻害で引き起こされるIGF-1の作用低下は、IBD患者に認められる胃腸の症状や徴候を増悪させる可能性があります4)。
臨床試験におけるIBDの発現状況5)
国内第Ⅲ相臨床試験(HZNP-TEP-303試験)において、IBDを合併する又は既往歴を有する患者は組み入れられず、二重遮蔽投与期間及びオープンラベル投与期間のいずれでもIBDの新規発症は認められませんでした。
海外第Ⅱ相試験(TED01RV試験)、海外第Ⅲ相試験(HZNP-TEP-301試験)、海外第Ⅲ相継続試験(HZNP-TEP-302試験)の併合解析において、IBDの悪化に関連する有害事象は、本剤で1.2%(1/84例)、プラセボ群では認められませんでした。本剤群で認められた事象は重度かつ重篤と判断され、本剤の投与中止に至りました。また、本患者はIBDによる部分的腸切除の手術歴を有していました。
HZNP-TEP-302試験集団では、IBDの新規発症及び悪化は認められませんでした。
対処法5,6)
- IBDの状態をモニタリングしてください。
- IBDの増悪を疑う場合は、本剤の投与中止を検討してください。
- 持続性又は反復性の粘血便・血性下痢等がありIBDが疑われるときには、理学的検査(バイタル、視診、触診、聴診等による腹部を含む全身の適切な身体診察)や血液検査(血算、炎症所見等)を行い、次に大腸内視鏡検査を考慮してください。
Infusion reaction
11.1.3 Infusion reaction(1.9%)
【解説】
Infusion reactionは、モノクローナル抗体のような外来タンパク質の注入で発現する可能性があります7,8 )。
投与開始から投与後1.5時間にあらわれることがあり、徴候及び症状として、一過性の血圧上昇、熱感、頻脈、呼吸困難、頭痛、筋肉痛などがあります 9)。
臨床試験における過敏症を含むInfusion reactionの発現状況9)
国内第Ⅲ相臨床試験(HZNP-TEP-303試験)における有害事象において、Infusion reactionは、二重遮蔽投与期間で本剤群、プラセボ群いずれも3.7%(1/27例)でした。本剤群では、1例に2件のInfusion reactionが認められました。2件ともに非重篤かつ軽度であり、投与中止や治療を要することなく1分以内に消失しました。オープンラベル投与期間では、初回治療の患者の1例(4.3%)にInfusion reactionが認められましたが、非重篤かつ中等度であり、投与中止には至りませんでした。いずれの投与期間でもアナフィラキシー反応は認められませんでした。
海外第Ⅱ相試験(TED01RV試験)、海外第Ⅲ相試験(HZNP-TEP-301試験)、海外第Ⅲ相継続試験(HZNPTEP-302試験)の有害事象における併合解析において、二重遮蔽化集団では、Infusion reaction(本剤投与開始後2時間以内に発現)は、本剤群7.1%(6/84例)、プラセボ群4.7%(4/86例)でした。潜在的なInfusion reaction(本剤投与日に発現したが、発現時刻が不明)は、本剤群3.6%(3/84例)、プラセボ群9.3%(8/86例)でした。アナフィラキシー反応はいずれの群においても認められませんでした。
HZNP-TEP-302試験集団では、Infusion reactionは、7.8%(4/51例)でした。また、潜在的なInfusion reactionは、1件でした。アナフィラキシー反応は認められませんでした。
対処法9)
- Infusion reactionが認められた場合等には、次回以降の投与では、投与前に抗ヒスタミン薬や解熱薬又は副腎皮質ステロイドを投与する、投与の速度を遅くする等の処置を検討してください。
- 症状に対する治療 (抗ヒスタミン薬、NSAIDs、副腎皮質ステロイド剤等) もしくは点滴の中断を検討してください。
聴覚障害
11.1.1 聴覚障害
耳鳴(4.8%)、聴力低下(3.8%)、感音性聴力低下(1.9%)、自声強聴(1.0%)、難聴(1.0%)、耳管開放(1.0%)等の聴覚障害があらわれることがある。
【解説】
本剤投与で聴覚の副作用発現の根底にある機序は、IGF-1経路にあると考えられます。IGF-1は、内耳の発達、並びに聴力の維持及び保護機構に極めて重要であることが知られています。ヒト及び動物の研究から、遺伝的IGF-1欠損症は重篤な難聴と関連することが示されています。発現機序は解明されていませんが、IGF-1と聴覚の健全性には強い関連性があることから、本剤によるIGF-1受容体阻害は聴覚障害のリスク因子と考えられます10,11)。
臨床試験における聴覚障害の発現状況12)
国内第Ⅲ相臨床試験(HZNP-TEP-303試験)において、聴覚障害に関連する有害事象は、二重遮蔽投与期間で本剤群14.8%(4/27例)、プラセボ群3.7%(1/27例)でした。
国内第Ⅲ相臨床試験(HZNP-TEP-303試験)での聴覚障害に関連する有害事象※1(二重遮蔽投与期間)
| 症例 | 関連する病歴※2 | 基本語 | 報告者の用語 | 発症時期 | CTCAE | 治療の有無 |
|---|---|---|---|---|---|---|
| 本剤群 | ||||||
| 症例1 | 突発性難聴 [片耳] |
感音性聴力低下 | 両耳の感音性 聴力低下 |
Day38 | Grade1 | 治療無し |
| 症例2 | - | 耳鳴 | 両耳の耳鳴 | Day79 | Grade2 | 治療有り※3 |
| 聴力低下 | 症状を伴わない 両耳の聴力低下 |
Day92 | Grade1 | 治療無し | ||
| 症例3 | - | 耳鳴 | 両耳の耳鳴 | Day3 | Grade1 | 治療無し |
| 聴力低下 | 両耳の聴力低下 | Day61 | Grade1 | 治療無し | ||
| 症例4 | 耳管狭窄 感音性聴力低下 |
耳鳴 | 両耳の耳鳴 | Day29 | Grade1 | 治療有り※4 |
| 感音性聴力低下 | 両耳の感音性 聴力低下の増悪 |
Day52 | Grade2 | 治療無し | ||
| 耳管開放 | 右耳の耳管開放 | Day84 | Grade2 | 治療有り※4 | ||
| プラセボ群 | ||||||
| 症例5※5 | 老人性難聴 | 感音性聴力低下 | 両耳の感音性 聴力低下 |
Day121 | Grade2 | 治療有り※6 |
MedDRA Version 26.0
CTCAE = Common Terminology Criteria for Adverse Events
※1 MedDRA SMQ「聴覚障害」(狭域)及び HLT「難聴」に該当する有害事象
※2 MedDRA SMQ「聴覚障害」(狭域)及び HLT「難聴」に該当する病歴
※3 アデノシン三リン酸二ナトリウム水和物及びニコチン酸アミド/パパベリン塩酸塩による治療
※4 メコバラミンによる治療
※5 オープンラベル投与期間に移行したが、オープンラベル投与期間に聴力低下が発現し、本剤の投与が中止された。
※6 デキサメタゾンリン酸エステルナトリウム、メコバラミン及びリマプロストアルファデクス、アモキシシリン水和物による治療
海外第Ⅱ相試験(TED01RV試験)、海外第Ⅲ相試験(HZNP-TEP-301試験)、海外第Ⅲ相継続試験(HZNPTEP-302試験)の併合解析において、二重遮蔽化集団では、聴覚障害に関連する有害事象は、本剤群9.5%(8/84例)、プラセボ群では認められませんでした。
HZNP-TEP-302試験集団では、聴覚障害に関連する有害事象は、11.8%(6/51例)であり、いずれも非重篤でした。
なお、海外市販後において、重篤かつ不可逆な聴覚障害が報告されています。
対処法
- 聴覚障害を評価できる体制が整備されていない医療施設において本剤の治療を行う場合、投与前及び投与期間中に定期的に耳鼻科専門の医師による診察を受け、本剤による投与開始や継続の可否を判断してください。
- 投与前及び投与中は定期的に患者の聴力検査を行い、患者の状態を十分に観察した上で、治療継続の可否を慎重に判断してください。
- 患者が聴覚障害の症状を訴えた場合には、耳鼻咽喉科を受診するよう患者を指導ください。また、本剤を投与していることを受診時に医師に伝えるよう患者へ伝えてください。
- 聴覚障害が発現した場合は、本剤を中止する可能性を含め、適切な処置を行ってください。
-
References
- Pollak M.: Clin Cancer Res. 2012; 18(1): 40-50.
- 承認時評価資料:器官別又は症候群別有害事象の解析 高血糖(2024年9月24日承認、CTD 2.7.4.2.6.1)
- 厚生労働省:重篤副作用疾患別対応マニュアル 高血糖, 2009.
- Safo MB and Slikiss RZ.: American Journal of Ophthalmology Case Reports. 2021; 22: 101069.
- 承認時評価資料:器官別又は症候群別有害事象の解析 下痢及び炎症性腸疾患の悪化(2024年9月24日承認、CTD2.7.4.2.6.3)
- 日本消化器病学会:炎症性腸疾患(IBD)診療ガイドライン2020(改訂第2版)
- Scherer K, et al.: J Dtsch Dermatol Ges. 2010; 8(6): 411-426.
- Teo HM, et al.: Ther Clin Risk Manag. 2021; 17: 1219-1230.
- 承認時評価資料:器官別又は症候群別有害事象の解析 注入に伴う反応及びアナフィラキシー反応(2024年9月24日承認、CTD2.7.4.2.6.2)
- Chern A, et al.: Otolaryngol Head Neck Surg. 2021; 165(6): 757-758.
- Yu CY, et al.: Am J Ophthalmol Case Rep. 2021; 24: 101202.
- 承認時評価資料:器官別又は症候群別有害事象の解析 聴覚障害(2024年9月24日承認、CTD 2.7.4.2.6.4)













