「効能又は効果」「用法及び用量」「警告・禁忌」等その他の項目の詳細につきましては、電子化された添付文書をご参照ください。
イベニティの臨床試験のうち、NEJMに掲載された1)ARCH試験をご紹介します。
国際多施設共同第Ⅲ相臨床試験(ARCH試験、海外データ)1,2)
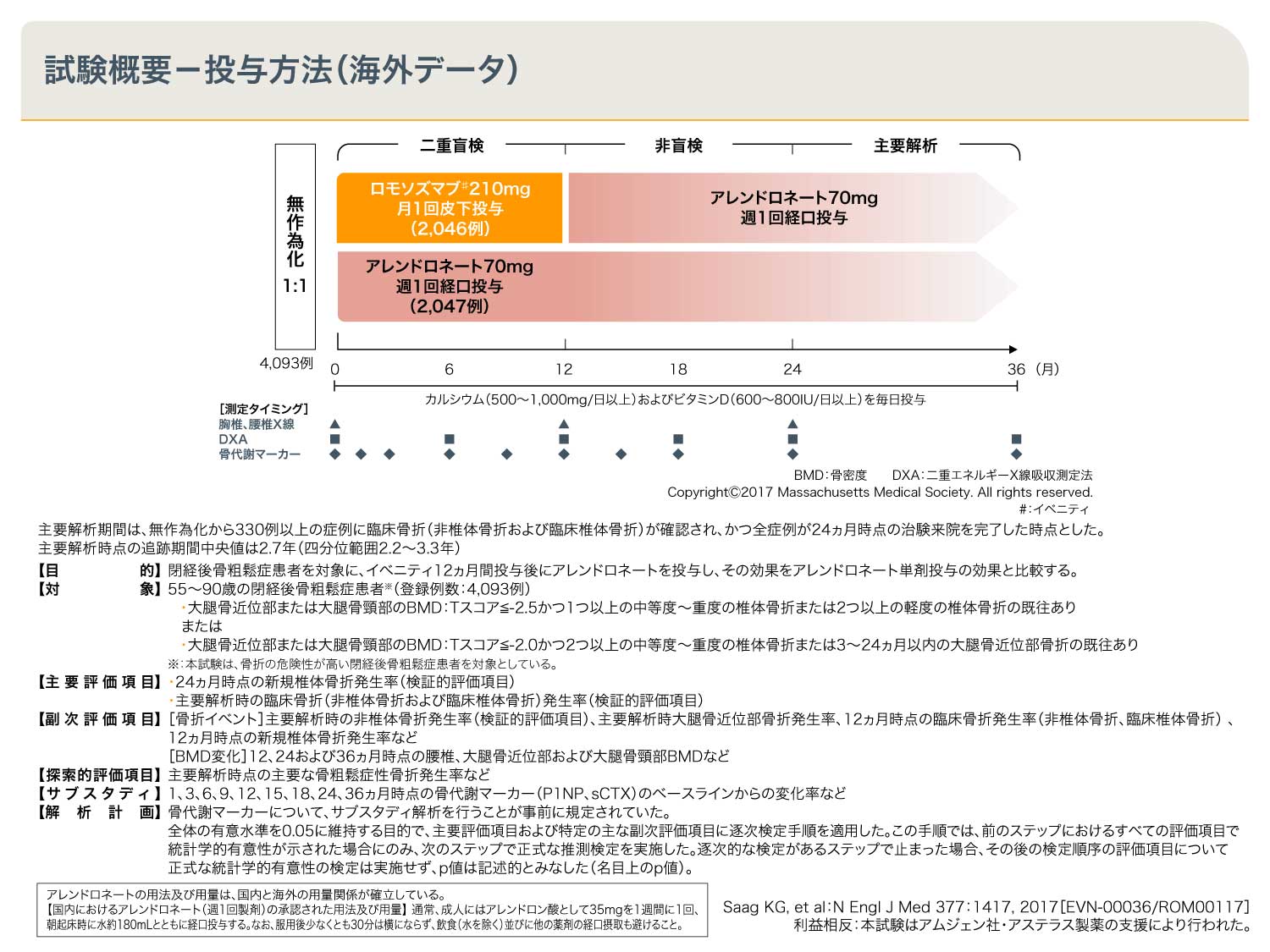
本試験では骨折の危険性が高い閉経後骨粗鬆症患者を対象に、イベニティ210mgを月1回12ヵ月間皮下投与またはアレンドロネート70mgを週1回12ヵ月間経口投与し、その後両群ともアレンドロネート70mgの週1回経口投与を継続しました。
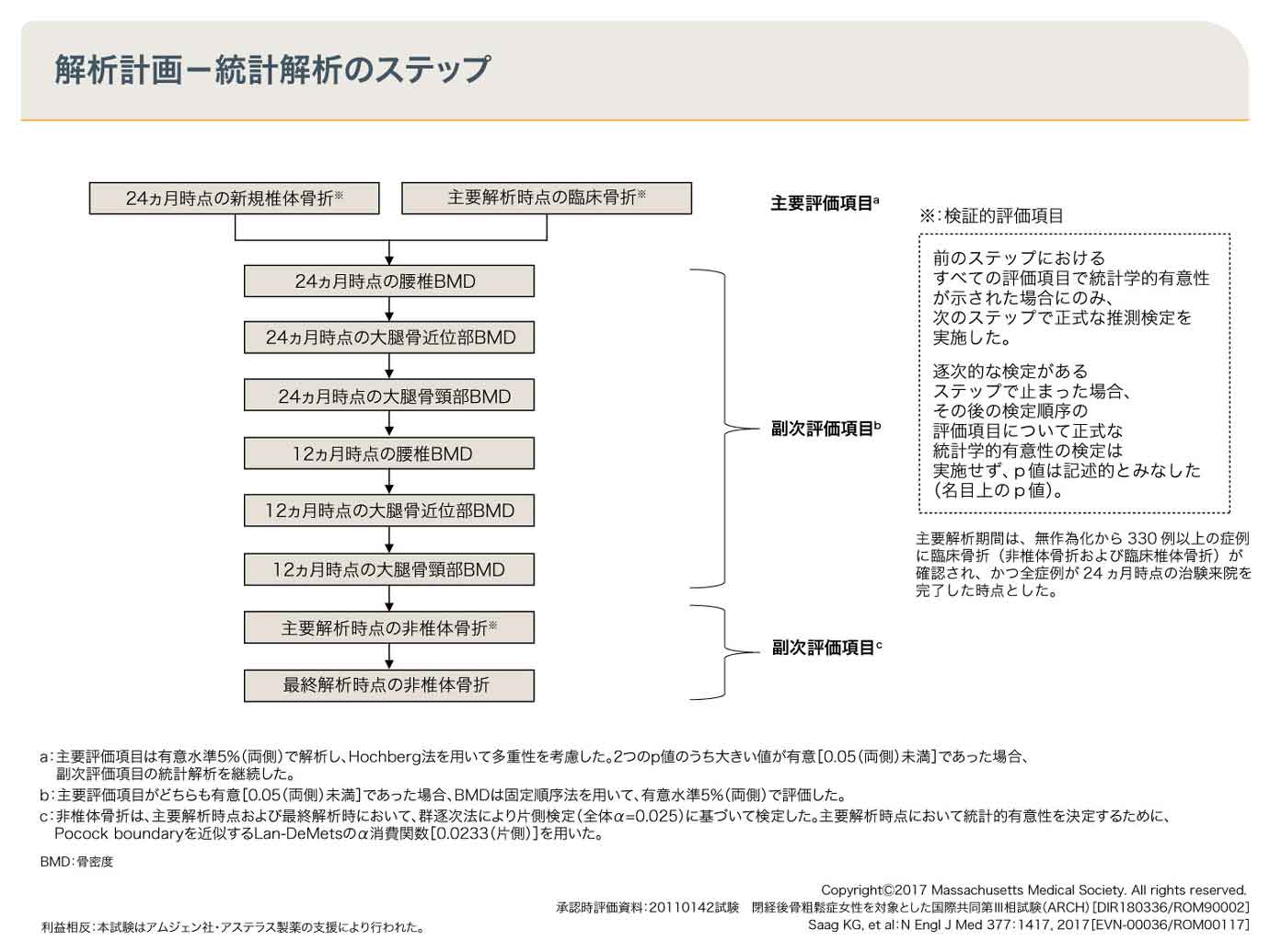
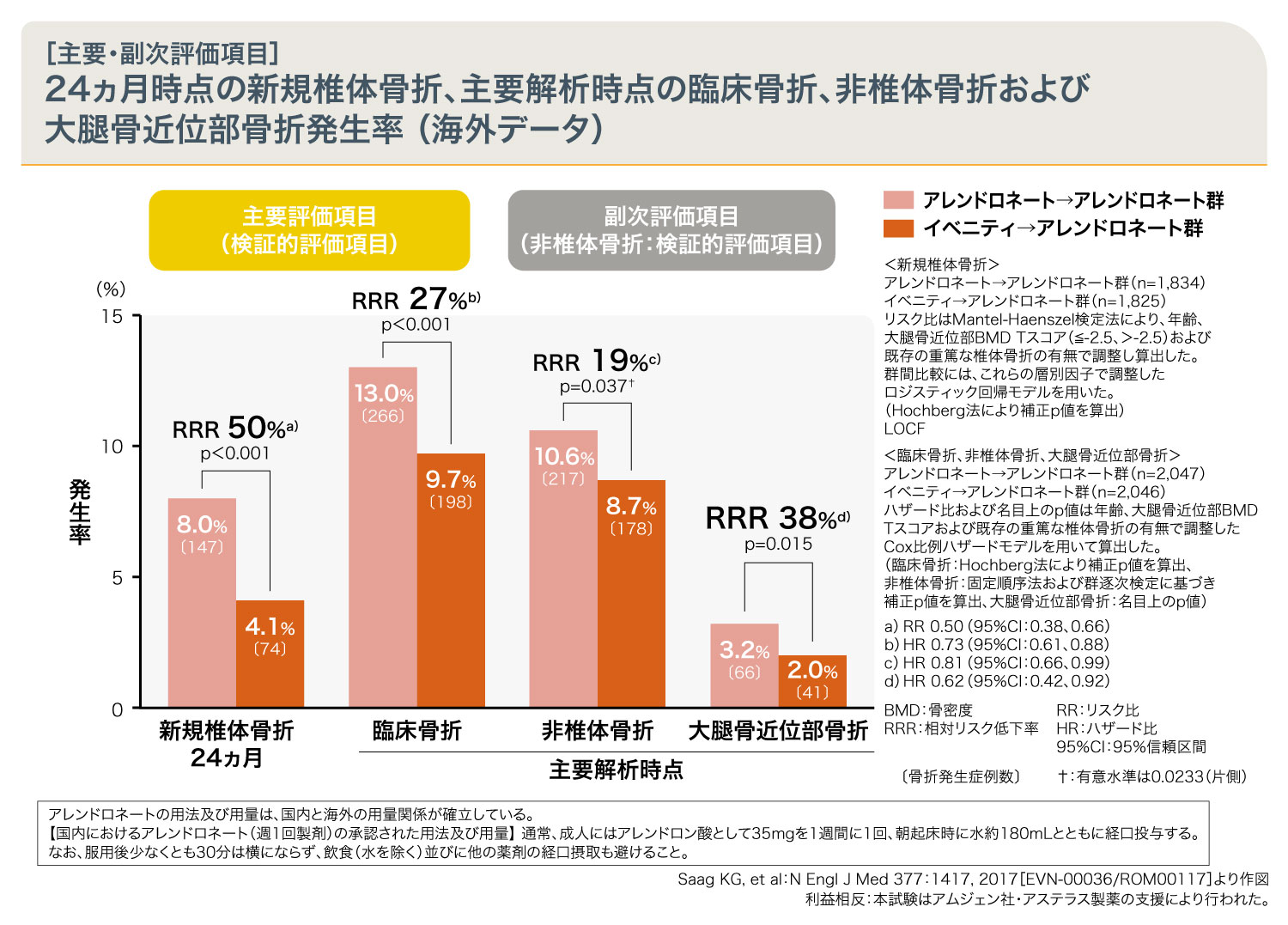
イベニティ→アレンドロネート群の24ヵ月時点での新規椎体骨折発生率は4.1%であり、アレンドロネート→アレンドロネート群の8.0%と比較して相対リスクが50%低下し、有意な差があることが検証されました。
同様に主要解析時点の臨床骨折および非椎体骨折において、イベニティ→アレンドロネート群ではアレンドロネート→アレンドロネート群と比較して有意な差があることが検証され、大腿骨近位部骨折においても有意差が示されました。
安全性
主要解析時点までの有害事象はアレンドロネート→アレンドロネート群1,784例(88.6%)、イベニティ→アレンドロネート群1,766例(86.6%)に認められた。主な有害事象はそれぞれの群で背部痛が393例(19.5%)、329例(16.1%)、鼻咽頭炎が373例(18.5%)、363例(17.8%)であった。有害事象による死亡例はそれぞれの群で90例(4.5%)[死亡17例(0.8%)、肺炎8例(0.4%)など]、90例(4.4%)[死亡13例(0.6%)、肺炎7例(0.3%)など]、重篤な有害事象は605例(30.0%)[大腿骨骨折47例(2.3%)、肺炎42例(2.1%)など]、586例(28.7%)[肺炎47例(2.3%)、大腿骨骨折38例(1.9%)など]、投与中止に至った有害事象は146例(7.2%)[上腹部痛、筋肉痛各6例(0.3%)など]、133例(6.5%)[消化不良9例(0.4%)、上腹部痛6例(0.3%)など]に認められた。
イベニティの承認された効能又は効果
骨折の危険性の高い骨粗鬆症
アレンドロネートの用法及び用量は、国内と海外の用量関係が確立している。
国内におけるアレンドロネート(週1回製剤)の承認された用法及び用量
通常、成人にはアレンドロン酸として35mgを1週間に1回、朝起床時に水約180mLとともに経口投与する。なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。
-
References
- Saag KG, et al:N Engl J Med 377:1417, 2017[EVN-00036/ROM00117]
利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。 - 承認時評価資料:20110142試験 閉経後骨粗鬆症女性を対象とした国際共同第III相試験(ARCH)[DIR180336/ROM90002]
- Saag KG, et al:N Engl J Med 377:1417, 2017[EVN-00036/ROM00117]








