「効能又は効果」「用法及び用量」「警告・禁忌」等その他の項目の詳細につきましては、電子化された添付文書をご参照ください。
イベニティの臨床試験のうち、LANCETに掲載された1)STRUCTURE試験をご紹介します。
国際多施設共同第Ⅲb相臨床試験(STRUCTURE試験、海外データ)2)

本試験では経口ビスホスホネート薬を3年間以上服用し、かつアレンドロネートを治験登録前の1年間に使用した骨折の危険性の高い閉経後骨粗鬆症患者を対象に、イベニティ210mgを月1回またはテリパラチド(遺伝子組換え)20μgを1日1回12ヵ月間皮下投与しました。
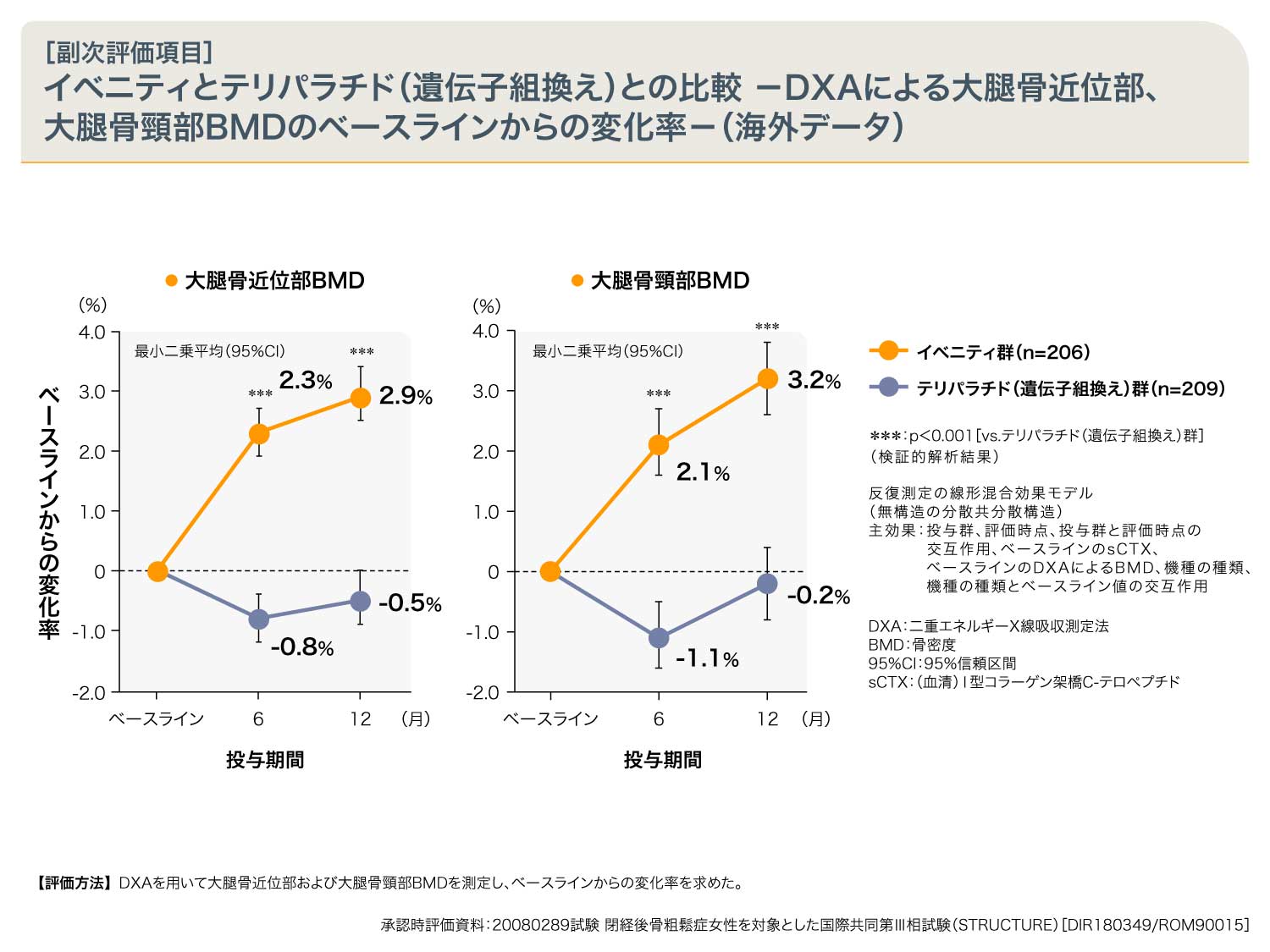
大腿骨近位部および大腿骨頸部の骨密度は、イベニティ群においては一過性の低下はみられず、テリパラチド(遺伝子組換え)群と比較して、6ヵ月、12ヵ月時点で有意な骨密度増加が認められました。
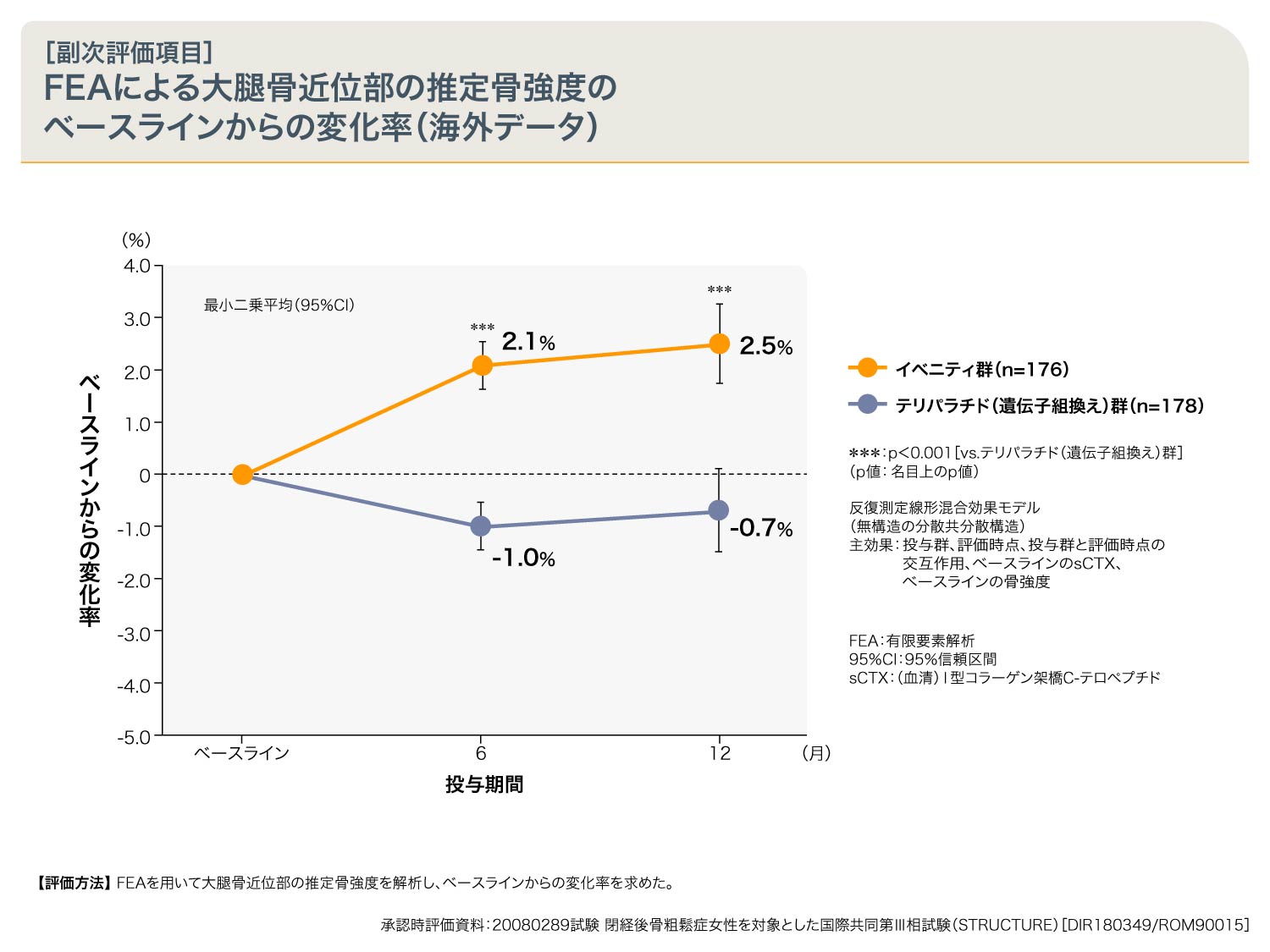
FEA(有限要素解析)による大腿骨近位部の推定骨強度は、6ヵ月、12ヵ月時点でイベニティ群はテリパラチド(遺伝子組換え)群と比較して有意な増加が認められました。
主要評価項目結果
DXAによる大腿骨近位部BMDのベースラインからの変化率(6、12ヵ月時点での治療効果の平均)は、イベニティ群においてテリパラチド(遺伝子組換え)群と比較し有意に増加することが検証された。 [p<0.001(多重性の調整あり)、反復測定の線形混合効果モデル(非構造の被験者間分散共分散構造)、固定効果:投与群、評価時点(カテゴリー変数)、ベースラインsCTX、ベースラインのDXAによる大腿骨近位部BMD、測定機種(カテゴリー変数)および測定機種とベースライン値の交互作用(ベースラインでのDXAによるBMDへの機種の影響の調整用)]
安全性
治験薬と関連のある有害事象はテリパラチド(遺伝子組換え)群39例(18.2%)、イベニティ群46例(21.1%)に認められた。治験薬と関連のある主な有害事象はテリパラチド(遺伝子組換え)群で悪心7例(3.3%)、関節痛6例(2.8%)、イベニティ群で注射部位疼痛、鼻咽頭炎各6例(2.8%)であった。本試験において治験薬と関連のある死亡例および重篤な有害事象は認められなかった。治験薬と関連のある投与中止に至った有害事象はテリパラチド(遺伝子組換え)群で6例(2.8%)、イベニティ群で4例(1.8%)に認められた。本資料・本論文中には治験薬と関連のある投与中止に至った有害事象の事象名に関する記載はなかった。
イベニティの承認された効能又は効果
骨折の危険性の高い骨粗鬆症
アレンドロネートの用法及び用量は、国内と海外の用量関係が確立している。
国内におけるアレンドロネート(週1回製剤)の承認された用法及び用量
通常、成人にはアレンドロン酸として35mgを1週間に1回、朝起床時に水約180mLとともに経口投与する。なお、服用後少なくとも30分は横にならず、飲食(水を除く)並びに他の薬剤の経口摂取も避けること。
-
References
- Langdahl BL, et al:Lancet 390:1585, 2017[EVN-00042/ROM00075]
利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。
- 承認時評価資料:20080289試験 閉経後骨粗鬆症女性を対象とした国際共同第III相試験(STRUCTURE)[DIR180349/ROM90015]
- Langdahl BL, et al:Lancet 390:1585, 2017[EVN-00042/ROM00075]








