
CodeBreaK 300試験において有効性・安全性が証明されました
- 対照群と比較して、PFSの有意な延長を示しました
- 奏効率においても改善が示されました
- 安全性:既報の範囲内であり、これまでに行われている方法で対応可能です
国際共同第Ⅲ相試験(CodeBreaK 300)1,2)
ルマケラス+パニツムマブ併用療法の適応追加は、国際共同第Ⅲ相試験(CodeBreaK 300)などのデータに基づいています。以下にCodeBreak 300の概要をご紹介します。この試験ではKRAS G12C変異を有する既治療の結腸・直腸癌患者を対象として、ルマケラス960mg又は240mgとパニツムマブとの併用療法と、対照薬(トリフルリジン/チピラシル又はレゴラフェニブ)を比較しました。
CodeBreaK 300試験には、国内の承認内容と異なる方法で治験薬が投与された患者が含まれていますが、承認時評価資料のため掲載しました。なお、本剤240mg+パニツムマブ群については、安全性データのみ示します。
試験デザイン
多施設共同[12ヵ国(日本、韓国、台湾、フランス、ドイツ、ギリシャ、イタリア、スペイン、英国、メキシコ、米国、オーストラリア)の67施設]、ランダム化、非盲検、実薬対照試験

<層別因子>
・ 血管新生阻害剤による治療歴(あり、なし)
・ 遠隔転移の初回診断からランダム化までの期間(18ヵ月以上、18ヵ月未満)
・ ECOG PS(0又は1、2)
【対象】KRAS G12C変異陽性の遠隔転移を有するCRC患者160例(日本人患者25例を含む)
【主要評価項目】無増悪生存期間(PFS)[検証的解析項目]
【副次評価項目】全生存期間(OS)、客観的奏効率[ORR、完全奏効(CR)+部分奏効(PR)]、病勢コントロール率[DCR、CR+PR+7週間以上の安定(SD)]、奏効期間(DOR)、奏効までの期間(TTR)、有害事象の発現と重症度、バイタルサインの変化、臨床検査値の変化、患者報告アウトカムの変化[簡易倦怠感調査票(BFI-SF)、簡易疼痛調査票(BPI-SF)、EORTC QLQ-C30、EuroQol-5D level5(EQ-5D-5L)、症状の煩わしさに関する単項目(FACT-G)のGP5の要約スコア、Patient Global Impression of Change(PGIC)の要約スコア]、ソトラシブ及びパニツムマブの薬物動態(PK)
【データカットオフ】2023年6月19日(OSは2023年12月18日)
-
〔解析計画〕
- 主要評価項目であるPFS及び重要な副次評価項目であるOSの主要解析は、最大の解析対象集団(FAS)を対象に実施した。
- PFSの主要解析は、ルマケラス960mg+パニツムマブ群と対照群でPFSイベントが約60件発生した時点で実施することとした(3群全体では約90件発生していると予測)。ルマケラス(240mg又は960mg)+パニツムマブ群と対照群に関する真の治療効果としてハザード比(HR)を0.4と仮定したとき、片側α=2.5%(両側5%)の半分である1.25%(両側2.5%)の有意水準でルマケラス+パニツムマブ群が優越性を示す検出力は90%であった。
- 事前に規定したサブグループ解析:血管新生阻害剤治療歴の有無、遠隔転移の初回診断からの期間、ECOG PS、地域、年齢、性別、人種、重複変異の有無、分化度、腫瘍占居部位、原発巣、遠隔転移診断後の治療歴(前治療数)、肝転移の有無、各薬剤使用歴(ベバシズマブ、アフリベルセプト、ラムシルマブ、免疫チェックポイント阻害剤、レゴラフェニブ、トリフルリジン/チピラシル、オキサリプラチン、イリノテカン、フッ化ピリミジン、オキサリプラチン+イリノテカン+フッ化ピリミジン)
- 日本人部分集団における有効性解析の群間比較では、各群のイベント数が極めて少ないことから、層別因子で調整しない解析も実施した。
- ルマケラス+パニツムマブ群の対照群に対するOSの優越性を検証する解析を2回実施する計画とした。PFSの主要解析の結果、ルマケラス(240mg又は960mg)+パニツムマブ群が統計学的に有意に良好であった場合、当該用量レベルでOSの中間要約を実施することとした。PFSの主要解析時には34件のOSイベントの発生が予測され、OSの真のHRが0.65の場合、本試験でHR<1となる確率は約90%であった。このOSの中間要約では、名目上の有意水準αとして0.01%を消費する想定とした(全体の第1種過誤率に及ぼす影響は無視できる)。その後、OSの最終解析は全3群において、約77件のOSイベント(約50%の成熟度)が観察された時点で実施することとした。
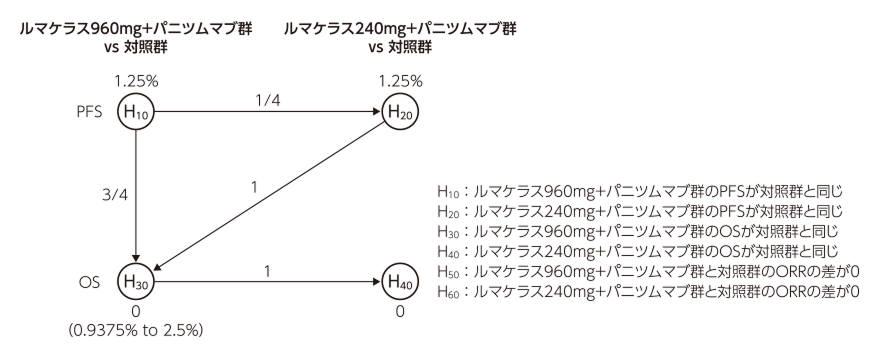
- PFS及び重要な副次評価項目(OS及びORR)に関する仮説は、試験全体の第1種過誤率を片側α=2.5%(両側α=5%)未満に制御するために、以下に示すグラフィカル多重検定法(Maurer-Bretz法)を用いて検定することとした。この方法では、1つの仮説を、他の仮説検定の棄却により再配分された新たな名目有意水準で繰り返し再検定することができる。
PFSの検定:2.5%の片側αを2つに分割し、1.25%ずつとした。H10を片側有意水準1.25%で検定し、H10が棄却された場合はH20を片側有意水準α/2+α/8(1.5625%)で検定することとした。
OSの検定:H20が棄却されればH30を片側有意水準3α/8+5α/8(2.5%)で検定し、H20が棄却されなければH30を片側有意水準3α/8(0.9375%)で検定することとした。また、H30が棄却された場合に限り、H40をH30と同じ片側有意水準で検定することとした。
ORRの検定:H30が棄却され、H20とH40がともに棄却された場合、H50を片側有意水準α(2.5%)で検定した後、H60を片側有意水準α(2.5%)で検定することとした。H30が棄却されH20が棄却されない場合(H40及びH60は検定しない)はH50を片側有意水準0.9375%で検定し、H30とH20がともに棄却されH40が棄却されない場合はすべてのαが消費され、ORRの仮説についてはいずれも検定されないこととなる。
- 副次評価項目である患者報告アウトカムの各評価項目については、投与群別及び時点別に記述的な解析を行った。また、BFI-SF、BPI-SF及びEORTC QLQ-C30については、反復測定の混合モデルを用いた解析を行い、ベースラインからの変化量の最小二乗平均値(LSM)の群間差について推定値並びに記述的なp値及び両側95%CIを算出した。
有効性
この試験では、主要評価項目のPFSについてルマケラス960mg+パニツムマブ群の対照群に対する優越性が検証されました。BICRに基づくPFS中央値は、ルマケラス960mg+パニツムマブ群5.62ヵ月、対照群2.04ヵ月、ハザード比(HR)0.48、両側p=0.005(層別log-rank検定*、有意水準0.0250)であり、ルマケラス960mg+パニツムマブ群でPFSが有意に延長しました(図2)。
OS中央値は、ルマケラス960mg+パニツムマブ群未到達(追跡期間中央値13.60ヵ月)、対照群10.25ヵ月(追跡期間中央値12.91ヵ月)、HR 0.70(95%CI 0.41, 1.18)、p=0.098(層別log-rank検定*、有意水準0.009375)でした(図3)。(有意差が認められなかったため階層的検定を終了した。)なお、対照群の17例(31.5%)が後治療としてKRAS G12C阻害薬を受けていました(表1)。
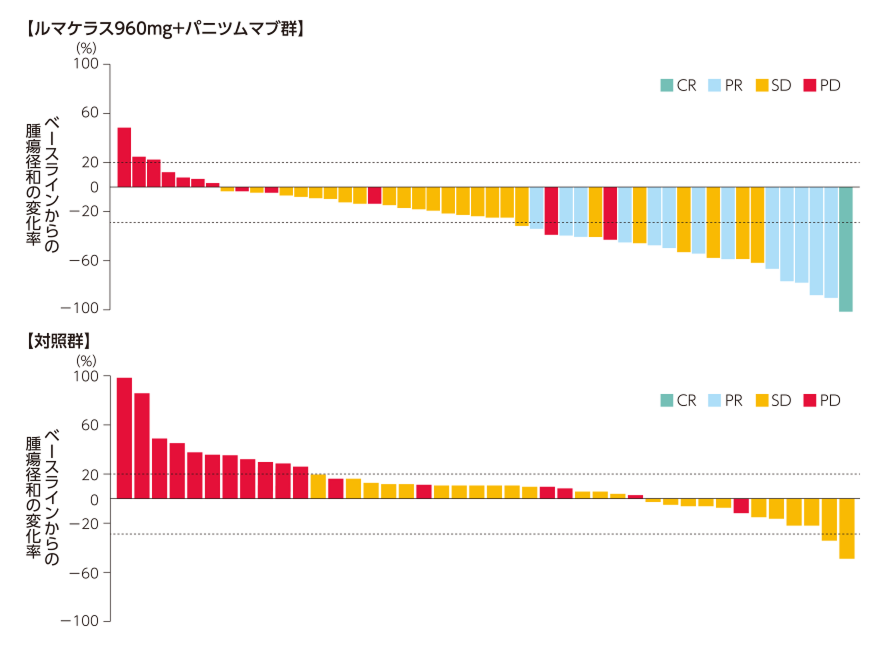
ORR、DCR、DOR、TTR及びwaterfall plotを図4、5に示します。
図2 無増悪生存期間(PFS)[主要評価項目][検証的解析結果]1,2)
![図2 無増悪生存期間(PFS)[主要評価項目][検証的解析結果]1,2)](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/crc/codebreak300/codebreak300-img3.png?h=458&iar=0&w=885&hash=D5C8D9AF679F55EA92C78396B1A13376)
-
図3 全生存期間(OS)[副次評価項目][検証的解析結果]1,3)
![図3 全生存期間(OS)[副次評価項目][検証的解析結果]1,3)](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/crc/codebreak300/codebreak300-img4.png)
-
表1 後治療1,3)
(データカットオフ日:2023年12月18日)
後治療の種類 ルマケラス960mg+
パニツムマブ群
(n=53)対照群
(n=54)後治療を受けた症例(クロスオーバーを含む) 23(43.4) 33(61.1) KRAS G12C阻害剤 1(1.9) 17(31.5) KRAS G12C阻害剤単剤 1(1.9) 0(0.0) ルマケラス* 1(1.9) 0(0.0) KRAS G12C阻害剤+抗EGFR抗体 0(0.0) 15(27.8) ルマケラス+パニツムマブ 0(0.0) 5(9.3) KRAS G12C阻害剤+他の併用薬 0(0.0) 2(3.7) 抗腫瘍薬 ベバシズマブ 9(17.0) 7(13.0) アフリベルセプト 0(0.0) 0(0.0) ラムシルマブ 1(1.9) 0(0.0) レゴラフェニブ 8(15.1) 8(14.8) トリフルリジン/チピラシル 12(22.6) 6(11.1) レゴラフェニブ又はトリフルリジン/チピラシル 15(28.3) 14(25.9) オキサリプラチン 5(9.4) 2(3.7) イリノテカン 1(1.9) 4(7.4) フルオロピリミジン 15(28.3) 13(24.1) オキサリプラチン+イリノテカン+フルオロピリミジン 1(1.9) 1(1.9) その他 6(11.3) 3(5.6) *:がん化学療法後に増悪したKRAS G12C変異陽性の治癒切除不能な進行・再発の結腸・直腸癌に対するルマケラス単独投与は、本邦適応外
n(%) -
図4 奏効率(ORR), 病勢コントロール率(DCR), 奏効期間(DOR))[副次評価項目]1,2)
(データカットオフ日:2023年6月19日)
![図4 奏効率(ORR), 病勢コントロール率(DCR), 奏効期間(DOR))[副次評価項目]1,2)](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/crc/codebreak300/codebreak300-img5.png)
-
図5 BORのwaterfall plot1,2)
(データカットオフ日:2023年6月19日)
安全性
有害事象は、ルマケラス960mg+パニツムマブ群53例(100%)、対照群49例(96.1%)で発現しました。
主な有害事象(いずれかの群で20%以上)は、低マグネシウム血症(ルマケラス960mg+パニツムマブ群34.0%、対照群2.0%、以下同順)、発疹(30.2%、2.0%)、下痢(26.4%、23.5%)、ざ瘡様皮膚炎(24.5%、2.0%)、皮膚乾燥(24.5%、2.0%)、悪心(15.1%、35.3%)、貧血(13.2%、21.6%)、嘔吐(11.3%、11.8%)、好中球減少症(0%、33.3%)でした。
表2 有害事象の発現状況1,2)
(データカットオフ日:2023年6月19日)
n(%)
| 発現例数(%) | ルマケラス960mg+ パニツムマブ群 (n=53) |
ルマケラス240mg+ パニツムマブ群 (n=53) |
対照群 (n=51) |
|---|---|---|---|
| 有害事象 | 53(100) | 53(100) | 49(96.1) |
| 主な事象(いずれかの群で20%以上に発現) | |||
| 低マグネシウム血症 | 18(34.0) | 18(34.0) | 1(2.0) |
| 発疹 | 16(30.2) | 12(22.6) | 1(2.0) |
| 下痢 | 14(26.4) | 14(26.4) | 12(23.5) |
| ざ瘡様皮膚炎 | 13(24.5) | 22(41.5) | 1(2.0) |
| 皮膚乾燥 | 13(24.5) | 14(26.4) | 1(2.0) |
| 悪心 | 8(15.1) | 16(30.2) | 18(35.3) |
| 貧血 | 7(13.2) | 8(15.1) | 11(21.6) |
| 嘔吐 | 6(11.3) | 12(22.6) | 6(11.8) |
| 好中球減少症 | 0(0) | 0(0) | 17(33.3) |
| 重篤な有害事象 | 14(26.4) | 17(32.1) | 15(29.4) |
| 主な事象(いずれかの群で3例以上に発現) | |||
| 敗血症 | 3(5.7) | 0(0) | 0(0) |
| 腸閉塞 | 2(3.8) | 3(5.7) | 0(0) |
| 小腸閉塞 | 0(0) | 3(5.7) | 0(0) |
| 減量に至った有害事象 | 11(20.8) | 10(18.9) | 11(21.6) |
| ルマケラスの減量 | 3(5.7) | 0(0) | ー |
| パニツムマブの減量 | 8(15.1) | 10(18.9) | ー |
| 両剤の減量 | 0(0) | 0(0) | ー |
| 投与中断に至った有害事象 | 26(49.1) | 32(60.4) | 29(56.9) |
| ルマケラスの投与中断 | 16(30.2) | 25(47.2) | ー |
| パニツムマブの投与中断 | 21(39.6) | 26(49.1) | ー |
| 両剤の投与中断 | 11(20.8) | 19(35.8) | ー |
| 投与中止に至った有害事象* | 1(1.9) | 3(5.7) | 2(3.9) |
| ルマケラスの投与中止 | 1(1.9) | 3(5.7) | ー |
| パニツムマブの投与中止 | 1(1.9) | 2(3.8) | ー |
| 両剤の投与中止 | 1(1.9) | 2(3.8) | ー |
| 死亡に至った有害事象 | 2(3.8) | 4(7.5) | 3(5.9) |
| 事象名 | 心停止(1例) | 腸閉塞(2例) | 急性心不全(1例) |
| 敗血症(1例) | 中枢神経系転移(1例) | 状態悪化(1例) | |
| 腹膜転移(1例) | 胸膜痛(1例) |
*:【事象名】ルマケラス960mg+パニツムマブ群は低カルシウム血症(1例)、ルマケラス240mg+パニツムマブ群は腹膜転移、悪心(各1例)、対照群は呼吸困難、胸膜痛、肝不全(各1例)でした。また、ルマケラス240mg+パニツムマブ群の1例は小腸閉塞によりルマケラスのみ中止しました。
※対照群に割り付けられながら治験薬を投与されなかった3例は、安全性解析対象集団に含めていません。
6.用法及び用量(一部抜粋)
〈がん化学療法後に増悪したKRAS G12C変異陽性の治癒切除不能な進行・再発の結腸・直腸癌〉
パニツムマブ(遺伝子組換え)との併用において、通常、成人にはソトラシブとして960mgを1日1回経口投与する。なお、患者の状態により適宜減量する。
投与スケジュール、用法及び用量
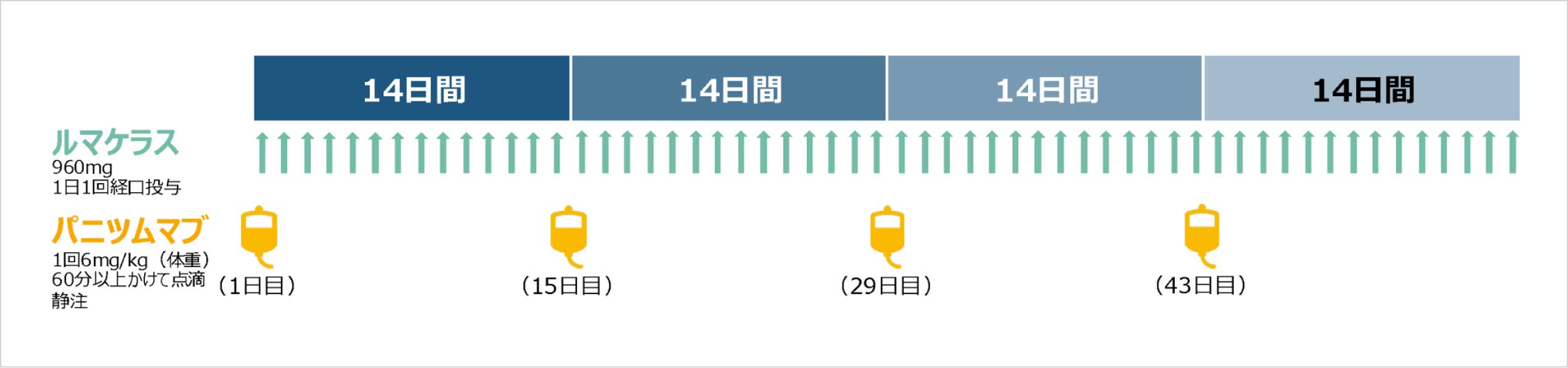
パニツムマブ(遺伝子組換え)との併用において、通常、成人にはソトラシブとして960mgを1日1回経口投与する。なお、患者の状態により適宜減量する。
1. ルマケラス電子化された添付文書第6版
(2025年9月改訂)
2. ベクティビックス電子化された添付文書第2版
(2025年9月改訂)
-
References
- 社内資料:20190172試験 国際共同第Ⅲ相試験(SOT90052)[ 承認時評価資料]
- Fakih MG, et al. N Engl J Med. 2023; 389(23): 2125-2139.(SOT00318)[ 利益相反:本試験はアムジェン社の支援により行われた。]
- Pietrantonio F, et al. J Clin Oncol. 2025; 43: 2147-2154.(SOT00541)[ 利益相反:本試験はアムジェン社の支援により行われた。]
ご採用やご投与にあたって、
不明点や弊社MRへご要望がある場合は下記へご連絡ください。
ご採用にあたって
- 採用に関する資料請求
- 採用にあたっての院内医療関係者への資料提供や情報提供のご依頼
ご投与にあたって
- 投与にあたっての検査に関するお問い合わせ
- 投与スケジュール・投与方法に関するお問い合わせ
- 投与にあたっての院内医療関係者への情報提供のご依頼
- 患者様向けインフォームドコンセント資材のご請求







