KRASとは
- シグナル伝達経路の中心的な役割をはたす重要な分子スイッチです
- KRAS変異は非小細胞肺がんにおいて頻度の高いドライバー遺伝子変異で、最も多い変異サブタイプはG12Cです
- KRASを標的とした薬剤の実現には “undruggable target” に立ち向かう40年間の研究と開発の歴史がありました
シグナル伝達経路の中心にあるKRAS
KRASは上流から下流へのシグナル伝達を仲介する重要なタンパク質であり、活性型であるGTP結合型(オン)と不活性型であるGDP結合型(オフ)とに切り替わることで、細胞分化や増殖を調節しています。細胞膜に存在するEGFRやALKといった受容体型チロシンキナーゼにリガンドが結合すると、KRASは活性型に変化し、下流にあるセリン・スレオニンキナーゼ等にそのシグナルを伝達し、細胞増殖やアポトーシスの抑制等を引き起こします。活性型のKRASは自身の内因性GTPase活性とGAP(GTPase活性化タンパク質)によりGTPを加水分解し、不活性型に切り替わります図1。
図1 KRASを介するシグナル伝達1,2)
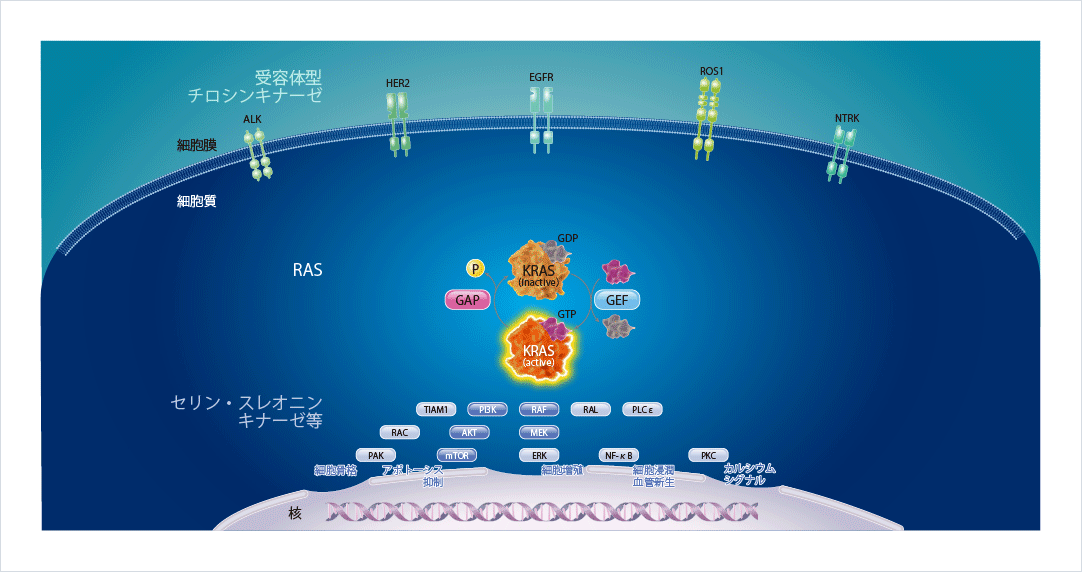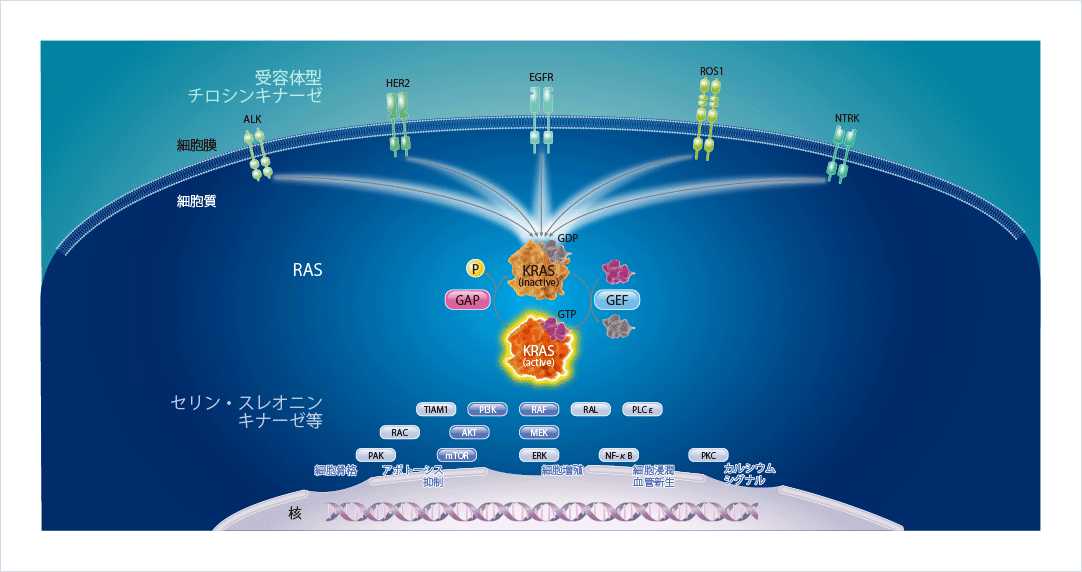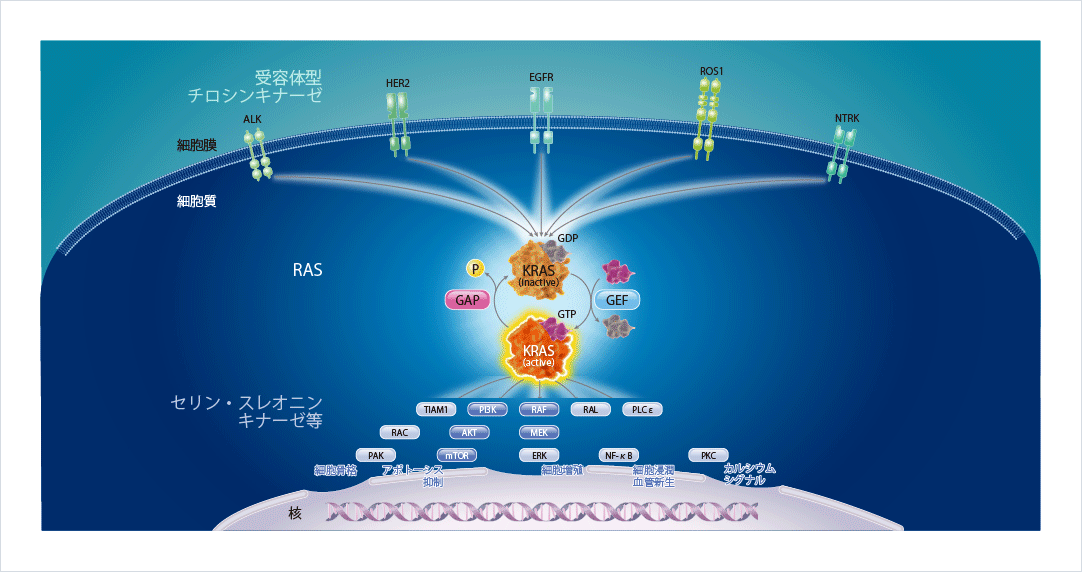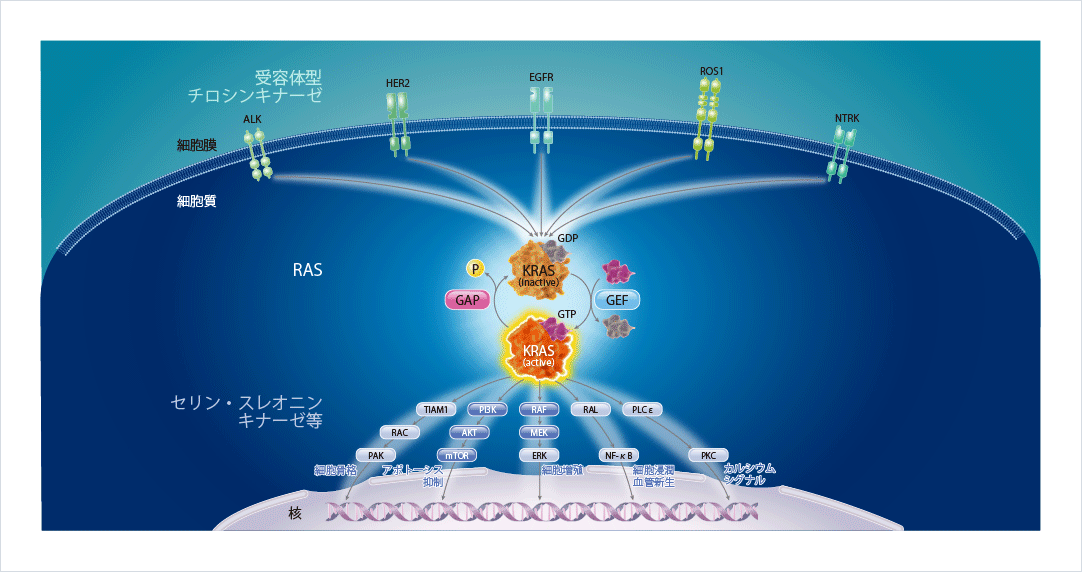
腫瘍形成の引き金となるKRAS G12C変異
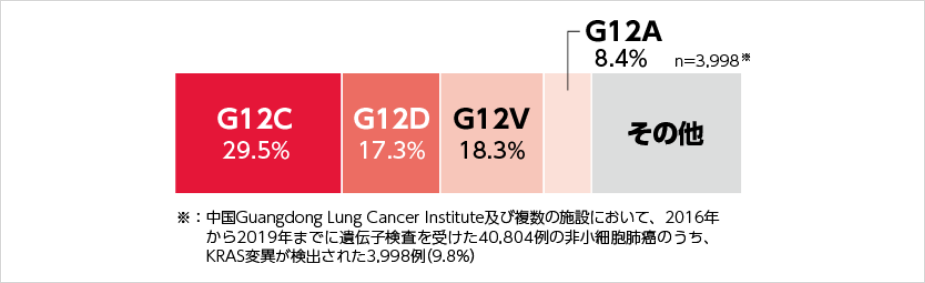
KRAS遺伝子はがんのドライバー遺伝子のひとつであり、日本人の肺腺がんではEGFRに次いで高頻度で変異を認めます図2。最も多い変異サブタイプはG12Cで、KRAS変異全体の29.5%を占めていました図3。KRAS G12C変異は、シグナル伝達の恒常的な活性化を引き起こし、腫瘍形成の引き金となることが示されています3) 。
図2 日本人のドライバー遺伝子変異分布 (国立がん研究センター)4)
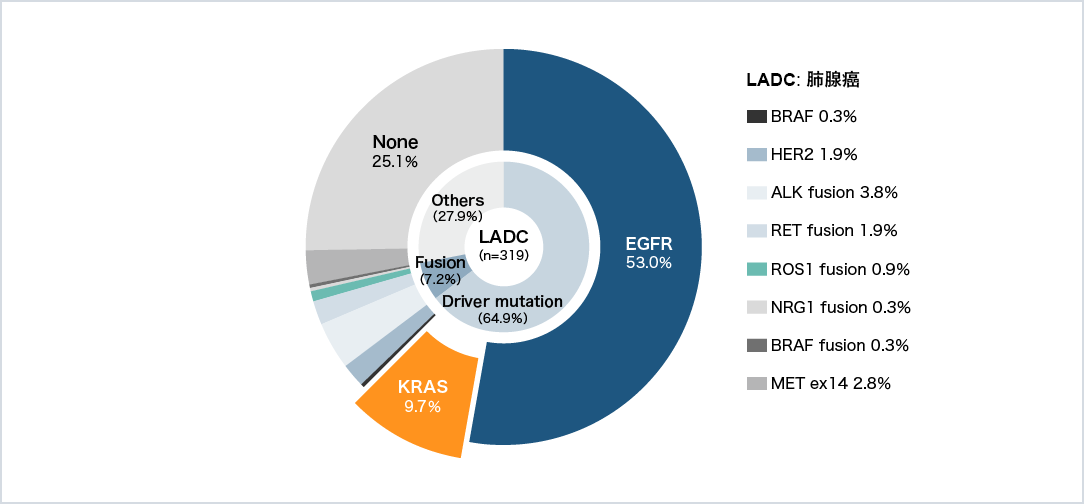
図3 KRAS遺伝子変異サブタイプの頻度(アジア人データ)5)
KRAS G12C阻害剤実用化までの道のり
1982年にヒトのがん遺伝子としてKRAS遺伝子が発見され、その後実際の肺がん患者からKRAS遺伝子変異が確認されたことから、KRAS変異を標的とした治療を目指し、様々な研究が行われてきました。しかし、いずれも実用化には至っておらず、長い失敗の歴史から、KRASは “undruggable target” と呼ばれるようになりました。契機が訪れたのは、2013年にKRASのSwitch IIポケットが発見され、これに結合する化合物がKRAS G12Cの活性を阻害することが報告された時でした。この発表以降、KRASに直接作用する薬剤の開発が急速に進展し、CodeBreaK 100試験開始から約3年後には、KRAS G12C阻害剤「ルマケラス」が世界で初めて米国において迅速承認されました。
図4 KRAS研究の歴史6-9)

-
References
- Muñoz-Maldonado C, et al. Front Oncol. 2019; 9: 1088.
- Takács T, et al. Cancer Metastasis Rev. 2020; 39: 1051-1065.
- Scheffzek K, et al. Science. 1997; 277: 333-338.
- Saito M, et al. Cancer Sci. 2016; 107: 713-720.
- Liu SY, et al. Biomark Res. 2020; 8: 22.
- Ghimessy A, et al. Cancer Metastasis Rev. 2020; 39: 1159-1177.
- Santos E, et al. Nature. 1982; 298: 343-347.
- Parada L F, et al. Nature. 1982; 297: 474-478.
- 社内資料:20170543試験 国際共同第I/II相試験










