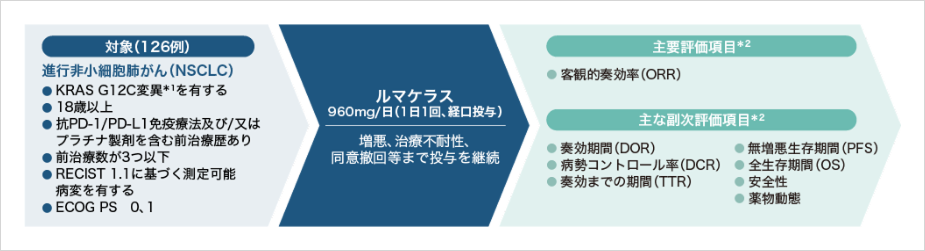
国際共同第Ⅰ/Ⅱ相試験(CodeBreaK 100)
- 国際共同第Ⅰ/Ⅱ相試験の第Ⅱ相パート(KRAS G12C変異を有する既治療の進行非小細胞肺がん患者126例)において、主要評価項目であるORRは37.4%(95%CI:28.8, 46.6)でした。(データカットオフ:2020年9月1日)
- 副作用発現率は全Gradeで、第Ⅱ相安全性解析対象集団(NSCLC126例)69.8%、第Ⅰ/Ⅱ相併合安全性解析対象集団(NSCLC190例)67.4%でした。第Ⅱ相安全性解析対象集団における主な副作用(10%以上)として、下痢、悪心、ALT増加、AST増加、疲労が認められています。
試験デザイン1)
「警告・禁忌を含む注意事項等情報」等は電子化された添付文書をご参照ください。
既治療のKRAS G12C変異を有する進行NSCLC患者に対する本剤の有効性は、主にCodeBreaK 100試験の第Ⅱ相部分の有効性の結果に基づき評価されました。第Ⅱ相部分のうち承認されたNSCLC患者集団のデータのみを示します。
主要目的
KRAS G12C変異を有する既治療の進行非小細胞肺がん患者(NSCLC)を対象に、ルマケラスを単独投与したときの客観的奏効率(ORR)を評価すること
試験デザイン
国際共同単群非盲検第Ⅰ/Ⅱ相試験(CodeBreaK 100試験/20170543試験)
解析計画
- 抗腫瘍効果に関する有効性評価項目の主要解析は、第Ⅱ相部分の最大の解析対象集団(P2FAS)*1を用いて実施した。
- 主要解析は、NSCLC患者105例又はCRC患者60例が第Ⅱ相部分に組み入れられた時点から約8.5ヵ月後に行う計画であった。
- ORR:事前に規定したベンチマークの値は23%とした*2。NSCLCの目標患者数を105例とした場合、真のORR改善を15%(期待ORRとして38%)と仮定すると、ORRの95%CIの下限が23%を上回る確率は約90%となる。このとき、ベンチマークとするORRを棄却できる最小のORRの観察値は32%となる。
- 事前に規定したサブグループ解析:日本人集団での解析、年齢(ベースライン時)、前治療の回数、PD-1/PD-L1阻害薬治療歴、プラチナ製剤を含む化学療法歴、PD-1/PD-L1阻害薬とプラチナ製剤を含む化学療法の治療歴、PD-L1発現レベル、ECOG PS (ベースライン時)、人種、性別、組織型、転移の有無、肝転移、脳転移又は骨転移の有無、喫煙歴及び地域について、ORRのサブグループ解析を実施した。
- 安全性の中間評価は、30、50、70及び100例の患者が組み入れられ、本剤を21日以上投与されたそれぞれの時点で実施した。
有効性評価項目の定義及び解析方法

患者背景

ルマケラスの有効性
主要評価項目
データカットオフ:2020年9月1日 (主要解析)1)、2021年3月15日 (有効性のアップデート)3)
客観的奏効率(ORR)[BICR評価]
-
データカットオフ:2021年3月15日
-
データカットオフ:2020年9月1日
主要評価項目であるORRは37.1%(95%CI:28.6, 46.2)でした。CRが4例(3.2%)に、PRが42例(33.9%)に認められました。
![図_客観的奏効率(ORR)[BICR評価]_データカットオフ:2021年3月15日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-1.png)
主要評価項目であるORRは37.1%(95%CI:28.6, 46.2)でした。CRが4例(3.2%)に、PRが42例(33.9%)に認められました。
![図_客観的奏効率(ORR)[BICR評価]_データカットオフ:2020年9月1日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-1a.png)
最良総合効果[BICR評価]のwaterfall plot*
-
データカットオフ:2021年3月15日
-
データカットオフ:2020年9月1日
![図_最良総合効果[BICR評価]のwaterfall plot_データカットオフ:2021年3月15日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-2.png)
![図_最良総合効果[BICR評価]のwaterfall plot_データカットオフ:2020年9月1日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-2a.png)
副次評価項目
データカットオフ:2020年9月1日 (主要解析)1)、2021年3月15日 (有効性のアップデート)3)
-
データカットオフ:2021年3月15日
-
データカットオフ:2020年9月1日
評価可能な124例中100例(80.6%)で病勢コントロールが得られました。DOR中央値は11.1ヵ月でした。
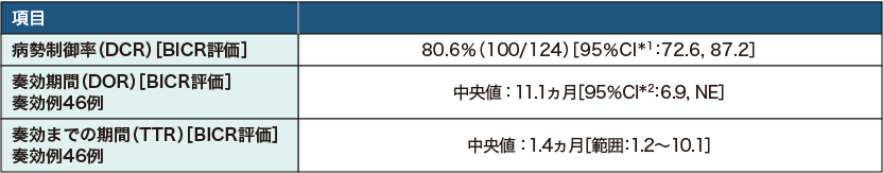
*1:Clopper-Pearson法
*2:Kaplan-Meier法
NE:評価不能
評価可能な123例中99例(80.5%)で病勢コントロールが得られました。DOR中央値は8.4ヵ月でした。

*1:Clopper-Pearson法
*2:Kaplan-Meier法
奏効例46例の奏効までの期間(TTR)及び奏効期間(DOR)のswimmer plot[BICR評価]
-
データカットオフ:2021年3月15日
-
データカットオフ:2020年9月1日
![図_奏効例46例の奏効までの期間(TTR)及び奏効期間(DOR)のswimmer plot[BICR評価]_データカットオフ:2021年3月15日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-4.png)
![図_奏効例46例の奏効までの期間(TTR)及び奏効期間(DOR)のswimmer plot[BICR評価]_データカットオフ:2020年9月1日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-4a.png)
無増悪生存期間(PFS)[BICR評価]
-
データカットオフ:2021年3月15日
-
データカットオフ:2020年9月1日
PFS中央値は6.8ヵ月でした。
![図_無増悪生存期間(PFS)[BICR評価]_データカットオフ:2021年3月15日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-5.png)
PFS中央値は6.7ヵ月でした。
![図_無増悪生存期間(PFS)[BICR評価]_データカットオフ:2020年9月1日](/-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak100/tabs-img-5a.png)
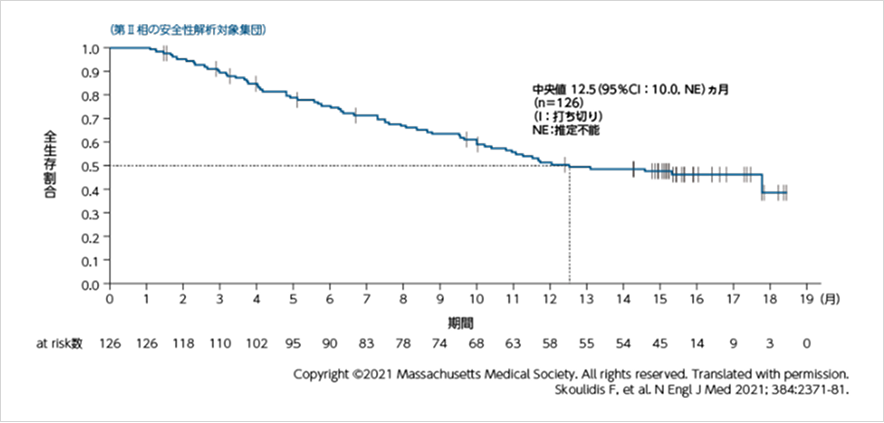
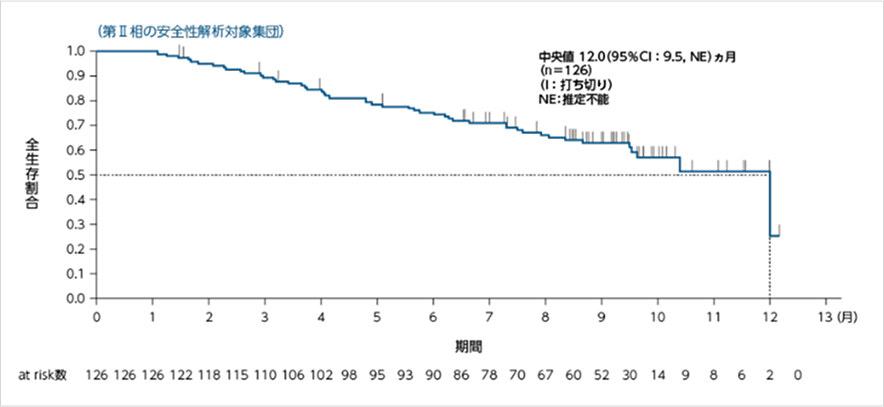
全生存期間(OS)
-
データカットオフ:2021年3月15日
-
データカットオフ:2020年9月1日
OS中央値は12.5ヵ月でした。
OS中央値は12.0ヵ月でした。
ルマケラスの安全性1)
副作用発現率は全Gradeで、第Ⅱ相安全性解析対象集団(NSCLC126例)69.8%、第Ⅰ/Ⅱ相併合安全性解析対象集団(NSCLC190例)67.4%でした。第Ⅱ相安全性解析対象集団における主な副作用(10%以上)として、下痢、悪心、ALT増加、AST増加、疲労が認められています。
-
第Ⅱ相 安全性解析対象集団*1(NSCLC126例)
-
第Ⅰ/Ⅱ相
併合安全性解析
有害事象*2 (データカットオフ日:2020年9月1日)
- 有害事象は126例中125例(99.2%)に認められました。主な事象(15%以上)は、下痢(62例)、悪心(37例)、疲労(31例)、アスパラギン酸アミノトランスフェラーゼ(AST)増加(27例)、アラニンアミノトランスフェラーゼ(ALT)増加(26例)、呼吸困難(24例)、嘔吐(23例)、便秘(22例)及び背部痛(20例)でした。
- 重篤な有害事象は63例(50.0%)に認められました。主な事象(3例以上)は、肺炎(9例)、NSCLC(8例)、胸水(6例)、背部痛(4例)、呼吸困難及び肺臓炎(各3例)でした。
- 投与中止に至った有害事象は11例(8.7%)に認められました。その内訳は、薬物性肝障害(3例)、ALT増加、AST増加及び肺臓炎(各2例)、胃潰瘍、血中ALP増加、肝機能検査値上昇、トランスアミナーゼ上昇、脱水、呼吸困難及び気胸(各1例)でした。
- 死亡に至った有害事象は18例(14.3%)に認められましたが、治験担当医師により治験薬と関連ありと判断された患者はいませんでした。
副作用一覧 (データカットオフ日:2020年9月1日)
第Ⅱ相部分の安全性解析対象集団(NSCLC:126例)における副作用(臨床検査値異常を含む)発現状況は下表のとおりでした。
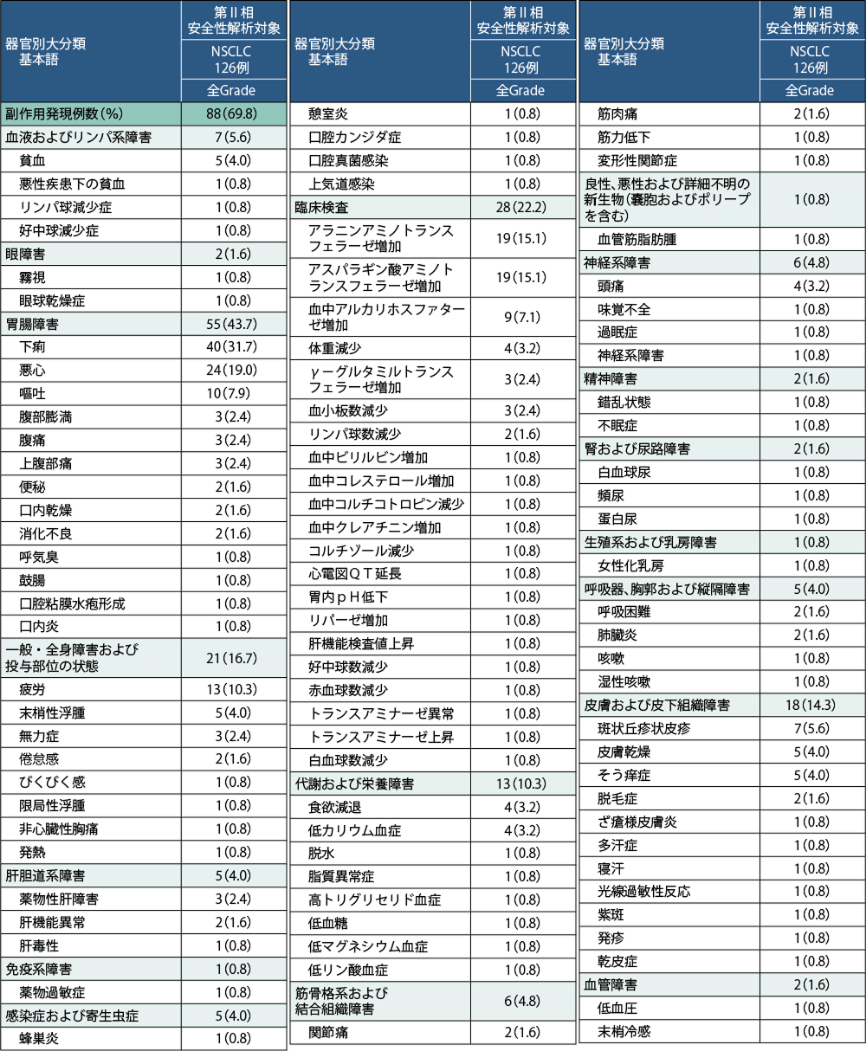
治験薬との因果関係が否定できない有害事象を副作用とし、有害事象名はMedDRA ver.23.0を用いてコード化し、MedDRA/J ver.23.0で翻訳した。Grade分類はCTCAE ver.5.0 に準じた。
有害事象* (データカットオフ日:第Ⅰ相 2020年7月6日、第Ⅱ相 2020年9月1日)
- 有害事象は190例中187例(98.4%)に認められました。主な事象(10%以上)は、下痢(82例)、悪心(52例)、疲労(44例)、アスパラギン酸アミノトランスフェラーゼ(AST)増加(40例)、アラニンアミノトランスフェラーゼ(ALT)増加(38例)、背部痛(35例)、便秘、呼吸困難、嘔吐(各32例)、咳嗽(27例)、血中アルカリホスファターゼ(ALP)増加(26例)、関節痛、食欲減退(各24例)、貧血、末梢性浮腫(各23例)、肺炎(20例)及び頭痛(19例)でした。
- 重篤な有害事象は99例(52.1%)に認められました。主な事象(2%以上)は、肺炎(14例)、NSCLC及び胸水(各9例)、呼吸不全(7例)背部痛(5例)、遠隔転移を伴う肺癌(4例)でした。
- 投与中止に至った有害事象は18例(9.5%)に認められました。2例以上に認められた事象は、ALT増加、AST増加及び薬物性肝障害(各3例)、血中ALP増加、肺臓炎及びトランスアミナーゼ上昇(各2例)でした。
- 死亡に至った有害事象は31例(16.3%)に認められました。2例以上に認められた事象は、NSCLC(8例)、遠隔転移を伴う肺癌及び呼吸不全(各4例)、心停止及び肺の悪性新生物(各2例)でした。死亡に至った呼吸不全及び心停止について医学的評価を行った結果、いずれの被験者にも死亡時点で病歴、疾患に関連する病態及び/又は増悪が認められました。
ドラッグ・インフォメーション4)
「警告・禁忌を含む注意事項等情報」等の改訂に十分ご留意ください。
1.警告
本剤は、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の使用が適切と判断される症例についてのみ投与すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2.禁忌(次の患者には投与しないこと)
本剤の成分に対し過敏症の既往歴のある患者
4.効能又は効果
がん化学療法後に憎悪したKRAS G12C変異陽性の切除不能な進行・再発の非小細胞肺癌
5.効能又は効果に関連する注意(抜粋)
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
その他の項目を含めた詳細についてはルマケラスの電子化された添付文書4)をご参照ください。
-
References
- 社内資料:20170543試験 国際共同第Ⅰ/Ⅱ相試験
- Garon EB, et al. Lancet. 2014; 384: 665-673.
- Skoulidis F, et al. N Engl J Med. 2021; 384: 2371-2381.[利益相反:本試験はAmgenの支援により行われた。]
- ルマケラスの電子化された添付文書第5版(2024年2月改訂)










