国際共同第Ⅲ相試験(CodeBreaK 200)
- 国際共同第Ⅲ相CodeBreaK 200試験では、主要評価項目である無増悪生存期間(PFS)についてルマケラスのドセタキセルの優越性が検証されました。PFS中央値は、ルマケラス群5.6ヵ月、ドセタキセル群4.5ヵ月、ルマケラス群のドセタキセル群に対するハザード比は、0.66でした。
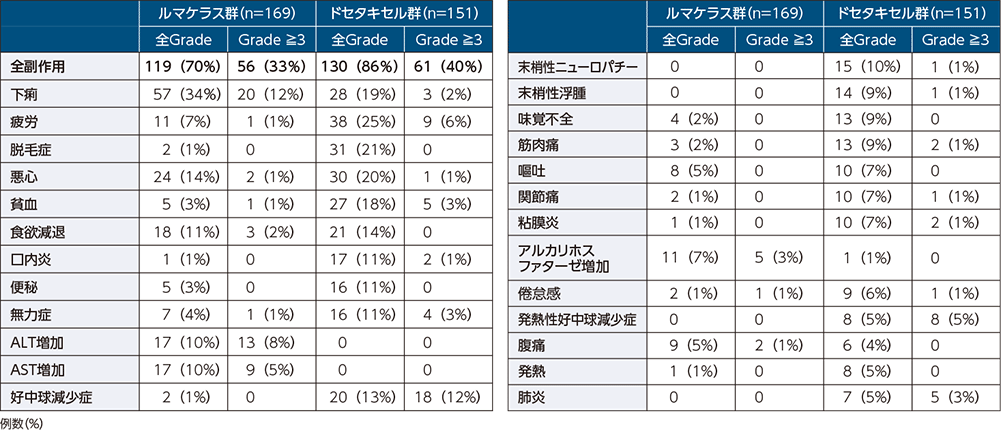
- 副作用発現率は、全Gradeでルマケラス群70%、ドセタキセル群86%でした。主な副作用(10%以上)は、ルマケラス群では下痢、悪心、食欲減退、ALT増加及びAST増加、ドセタキセル群では疲労、脱毛症、悪心、下痢、貧血、食欲減退、好中球減少症、口内炎、便秘、無力症及び末梢性ニューロパチーでした。
試験デザイン1,2)
「警告・禁忌を含む注意事項等情報」等は電子化された添付文書をご参照ください。
目的
KRAS G12C変異を有する既治療の局所進行/切除不能又は再発の非小細胞肺癌患者を対象に、ルマケラスのドセタキセルに対する優越性を検証し、安全性を検討すること
試験デザイン
国際共同非盲検無作為化第Ⅲ相試験
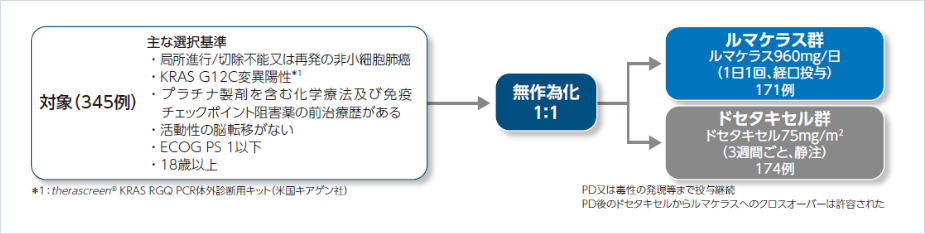
割付け因子:治療歴(1 vs 2 vs >2)、人種(アジア人 vs アジア人以外)、中枢神経系(以下:CNS)転移の病歴(あり vs なし)
主要評価項目:無増悪生存期間(PFS)*2
重要な副次評価項目:全生存期間(OS)、客観的奏効率(ORR)*2、患者報告アウトカム(PRO:呼吸困難、咳嗽、胸痛、身体機能、全般的健康)
その他の副次評価項目:奏効期間(DOR)*2、奏効までの期間(TTR)*2、病勢コントロール率(DCR)*2、安全性/忍容性、後治療、PRO(悪化までの期間)等
探索的評価項目:CNS再発*3
*2:RECIST 1.1に基づくBICRによる *3:医師判定
登録期間:2020年6月4日~2021年4月26日、プロトコール変更:2021年2月15日(予定被験者数を650例から330例に減らし、PFSのみの検出感度に変更)
データカットオフ日:2022年8月2日 追跡期間中央値:17.7ヵ月(IQR:16.4-20.1)
BICR:blinded independent central review、盲検下独立中央判定、IQR:四分位範囲
NCT04303780; EudraCT:2019-003582-18
解析計画
- 主要評価項目と重要副次評価項目の解析は、full analysis set(FAS)を対象とした。
- 安全性の評価は、少なくとも1回治験薬の投与を受けた症例を対象とした。
- 中間解析:PFSイベントが約70%(160件)に観察された時点でPFSの中間解析を実施した。第1種過誤を最小にするためにO’Brien-Fleming消費関数*4を用いて主要解析を実施する計画であった。Maurer-Bretz多重検定法*5を用いて主要評価項目のPFSにおいて統計学的有意差が認められた場合にOSとORRの解析を実施する。
- 主要解析:約230件のPFSイベントが観察された時点においてPFSの主要解析が計画された。OSに関してはイベント数が約198件に達した時点において主要解析を実施し、ORRに関してはPFSについて統計学的有意差が確認され、最終の無作為化症例で6週間のfollow-upが経過した時点で実施する。
- 最終解析:最終患者の長期follow-upが完了した時点で実施する。
- PFSに関して帰無仮説が棄却された場合、ORRは片側有意水準0.005を用いて検定する。ORRの帰無仮説が棄却された場合、OSは片側有意水準0.025を用いて検定する。ORRの帰無仮説が棄却されなかった場合には、PFS ⅠAでは片側有意水準0.0001、それ以外では片側有意水準0.02を用いてOSを検定する。
- OSの帰無仮説が棄却された場合、ORRを片側有意水準0.025を用いて検定する。
- PFS、OS、ORRすべてについて帰無仮説が棄却された場合に、ベースラインから12週時点までの肺癌の症状(呼吸困難、咳嗽、胸痛の3種)の検定をHolm手順を用いて検定する。
- 事前に規定されたサブグループ解析:年齢、性別、地域、喫煙歴、人種、ECOG PS、前治療の回数、CNS転移の既往、肝転移、骨転移、PD-L1発現率、前治療での最良効果について、PFSのサブグループ解析を実施した。
有効性評価項目の定義及び解析方法
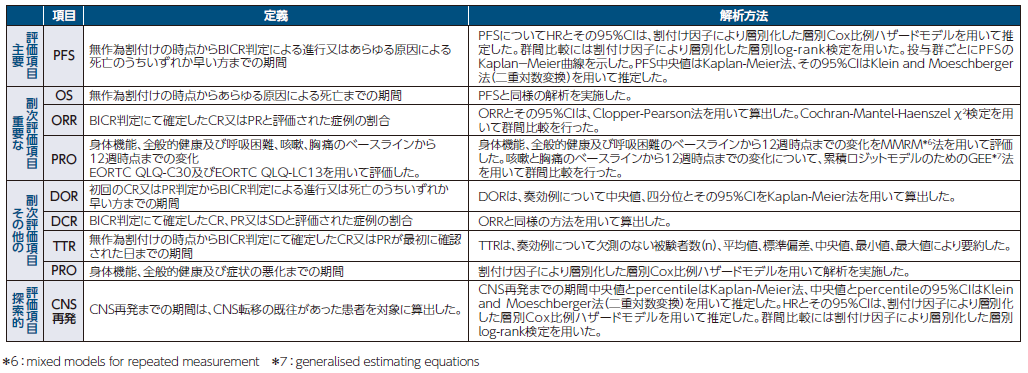
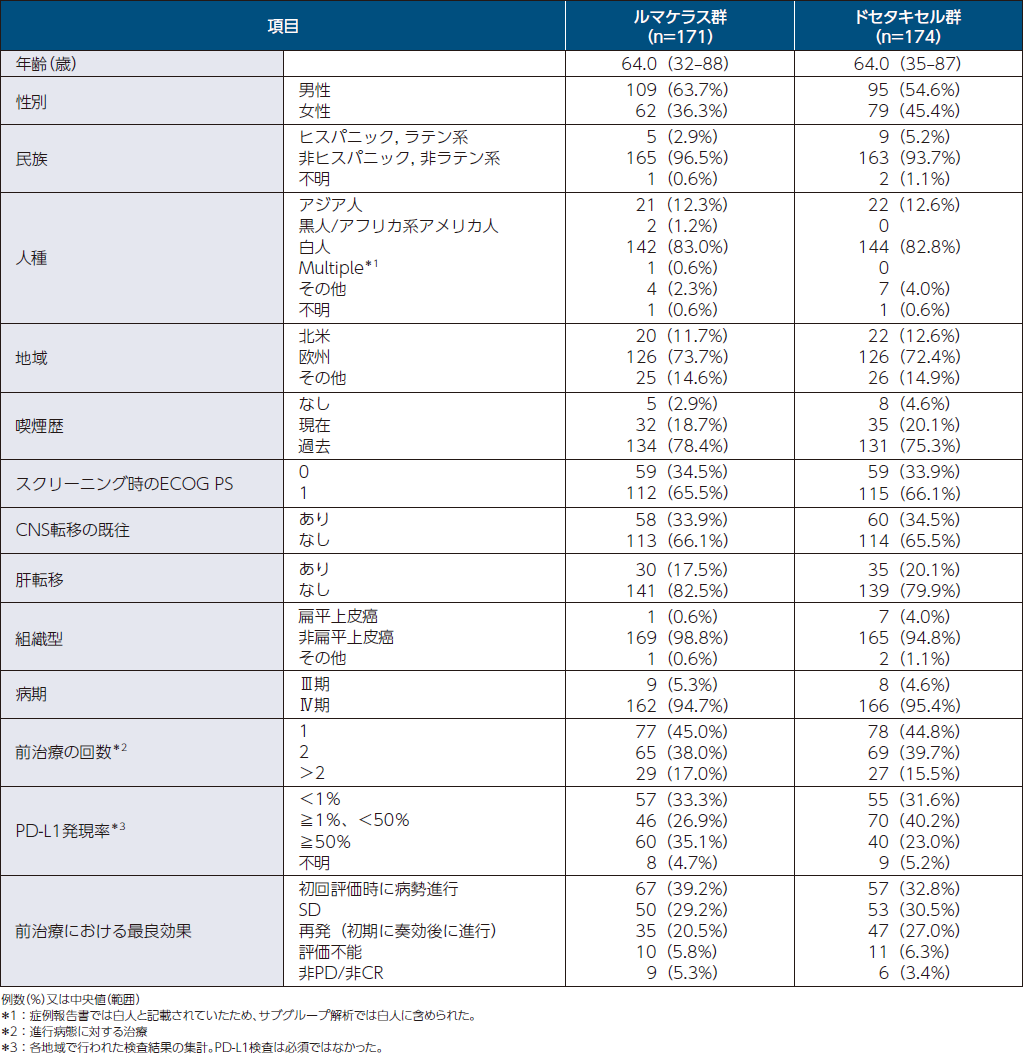
患者背景
ルマケラスの有効性1,2)
主要評価項目
データカットオフ:2022年8月2日 追跡期間中央値:17.7ヵ月(IQR:16.4-20.1)
無増悪生存期間(PFS)[BICR評価]1)
CodeBreaK 200試験では、主要評価項目であるPFSについてルマケラスのドセタキセルに対する優越性が検証されました。
![図_無増悪生存期間(PFS)[BICR評価]](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak200/lmk_codebreak200_fig02b.png?h=2092&iar=0&w=4322&hash=04E07114690ED37016EA1549DCEEB99E)
PFS[BICR評価]のforest plot[サブグループ解析]1)
![図_ PFS[BICR評価]のforest plot[サブグループ解析]](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak200/lmk_codebreak200_fig03.png?h=533&iar=0&w=925&hash=9C13F2BCE49D2CD619483E9732A5269D)
副次評価項目
データカットオフ:2022年8月2日 追跡期間中央値:17.7ヵ月(IQR:16.4-20.1)
客観的奏効率(ORR)と病勢コントロール率(DCR)[BICR評価]1)
ORRは、ルマケラス群28.1%、ドセタキセル群13.2%でした。
![表_客観的奏効率(ORR)と病勢コントロール率(DCR)[BICR評価]](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak200/lmk_codebreak200_table03.png?h=149&iar=0&w=1040&hash=FE7D6A55A97E6FB2D41FC66A08167CB7)
最良総合効果(BICR)のwarterfall plot2)
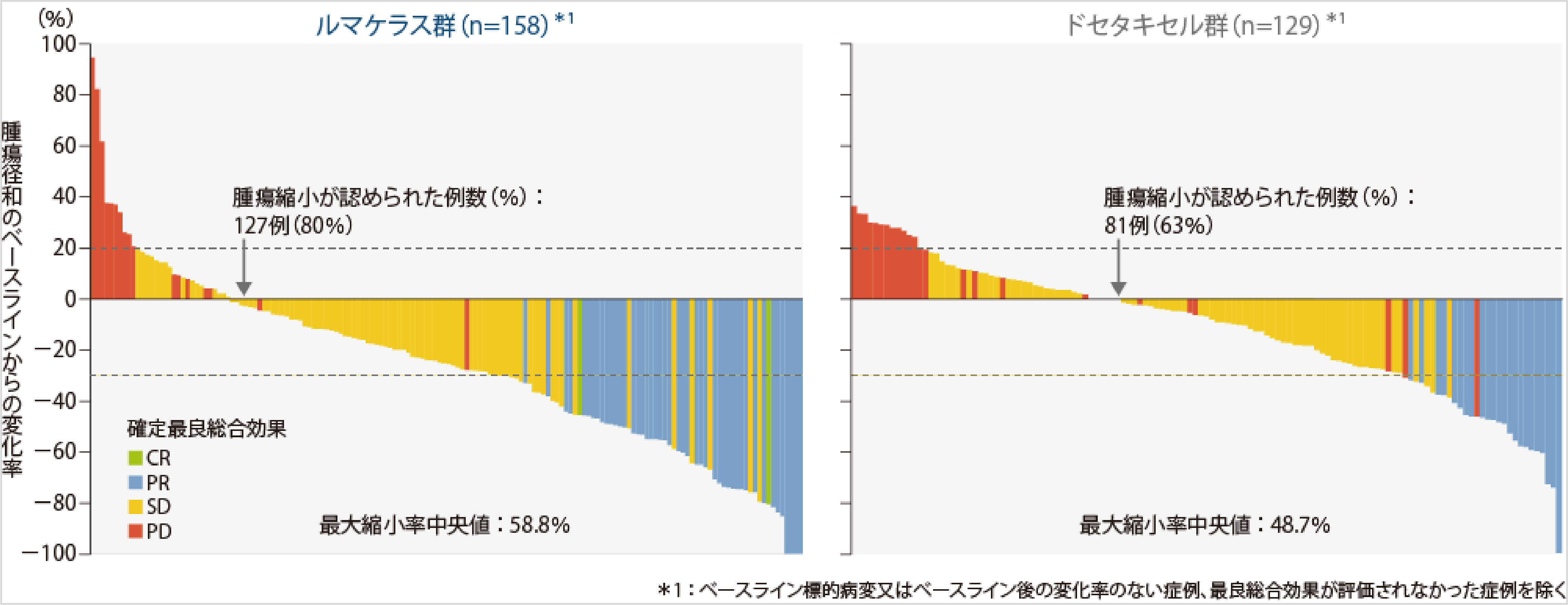
奏効(BICR)のswimmer plot2)
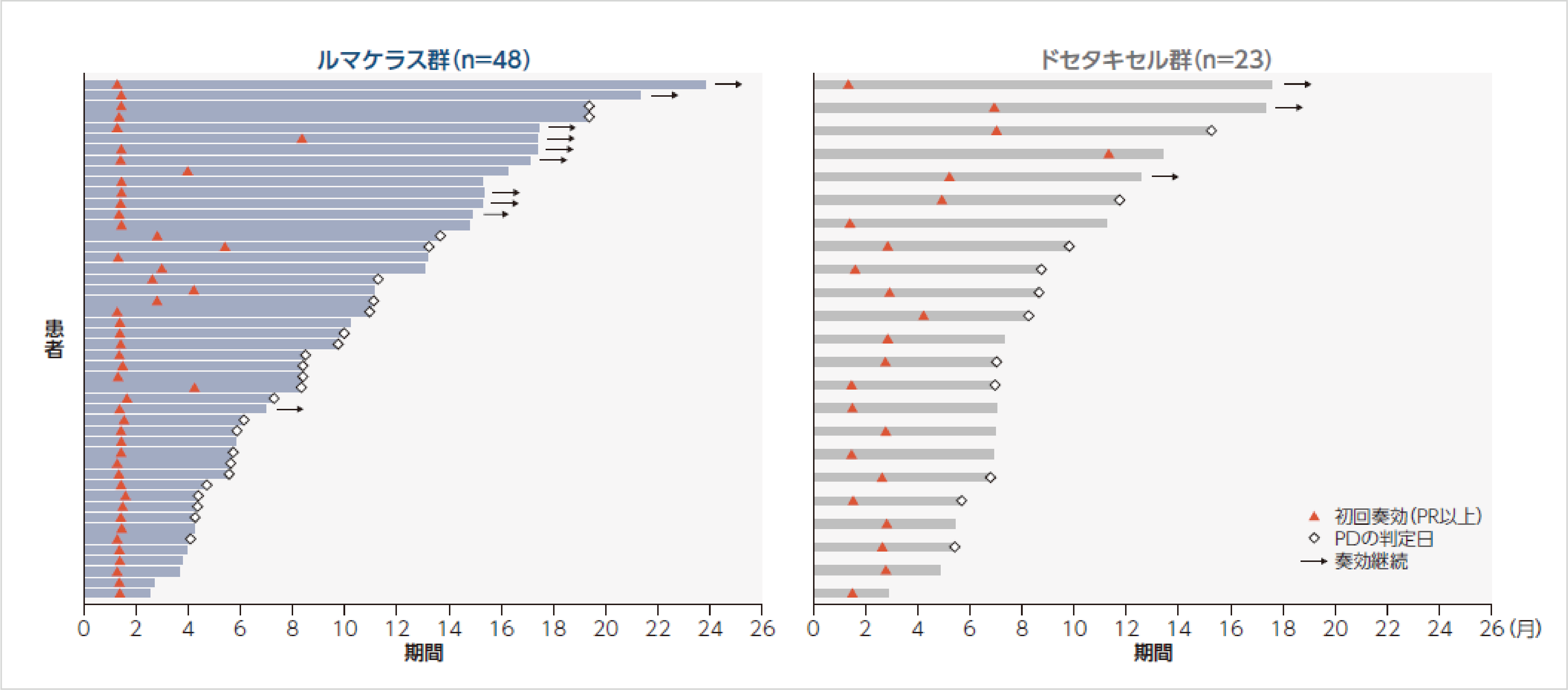
奏効期間及び奏効までの期間(BICR)1)
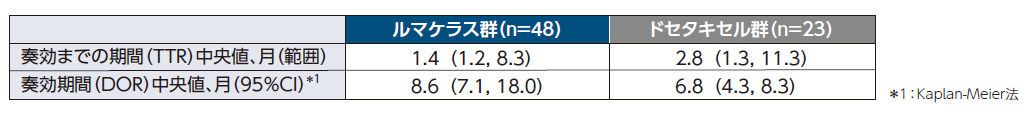
DOR中央値は、ルマケラス群8.6ヵ月、ドセタキセル群6.8ヵ月でした。
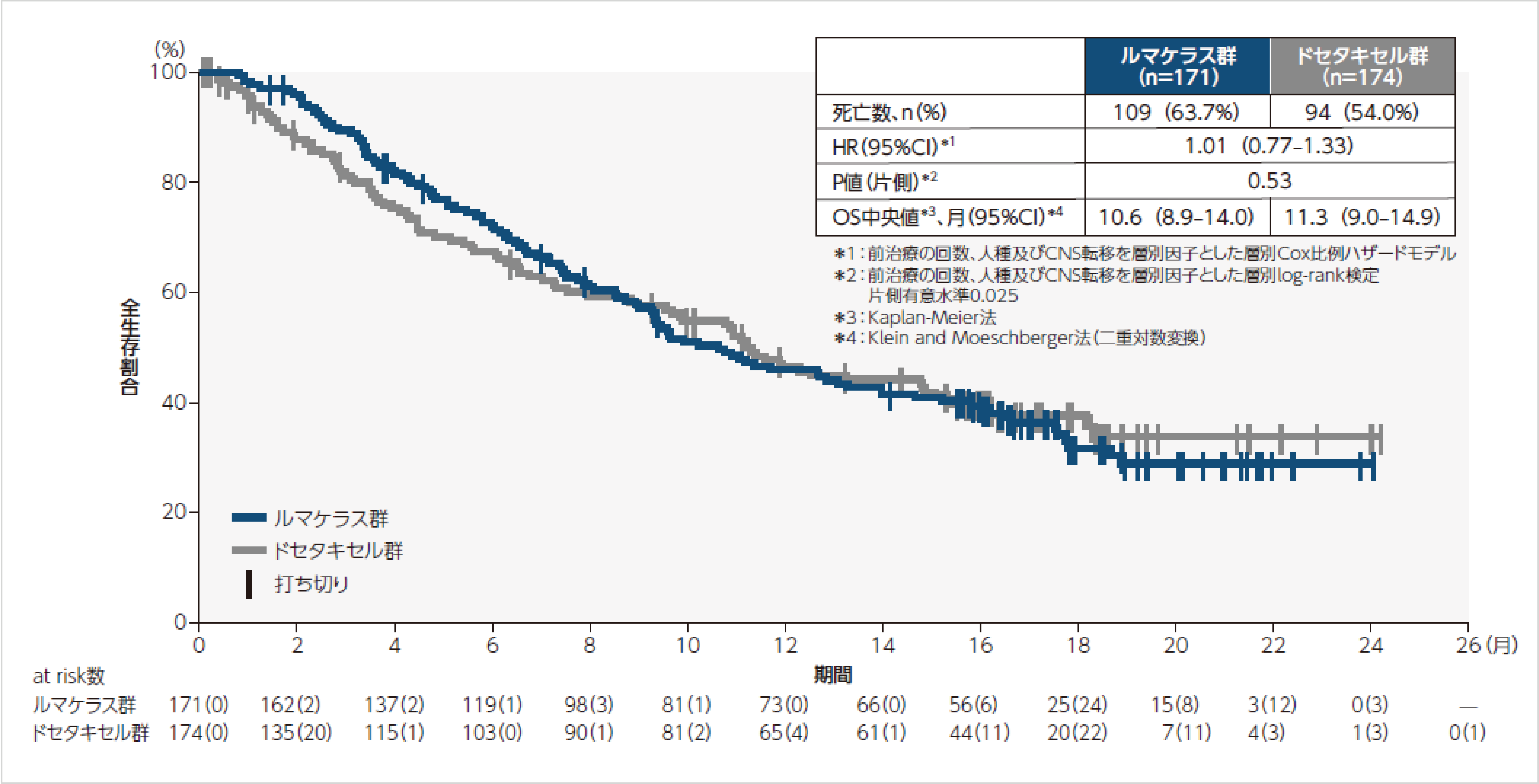
全生存期間(OS)1)
生存期間中央値は、ルマケラス群10.6ヵ月、ドセタキセル群11.3ヵ月でした。
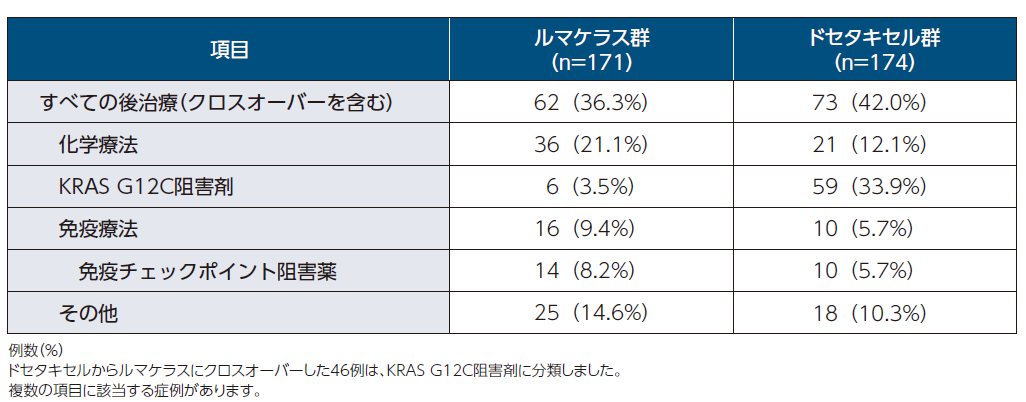
後治療2)
ルマケラス群の3.5%、ドセタキセル群の33.9%が後治療としてKRAS G12C阻害剤の投与を受けていました。
ルマケラスの安全性1,2)
副作用一覧1)
いずれかの群で5%以上に発現した全Gradeの副作用、及び3%以上に発現したGrade 3以上の副作用
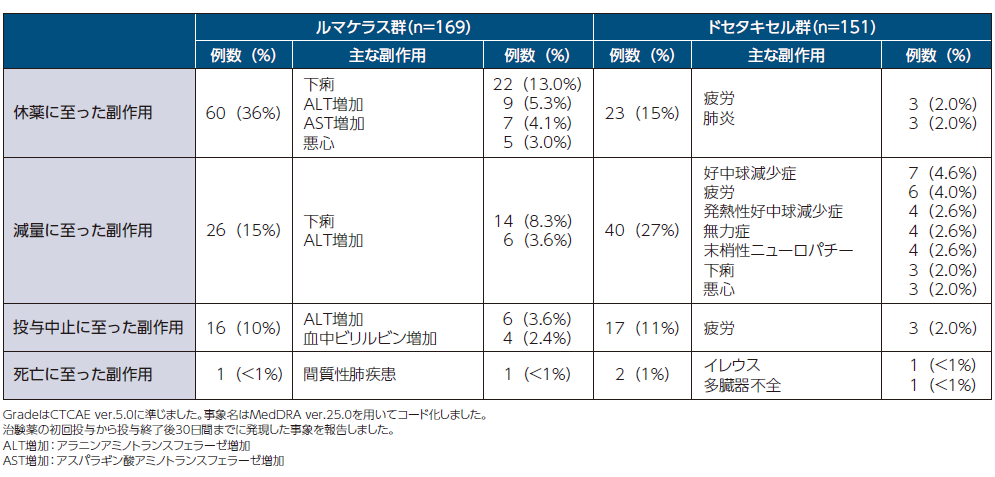
休薬/減量/投与中止/死亡に至った副作用の発現率と主な副作用 1,2)
患者報告アウトカム(PRO)1)
CodeBreaK 200試験では、QOLと呼吸器症状について患者報告アウトカム(PRO)評価が実施されました。
(参考情報)患者報告アウトカム(PRO)[副次評価項目]
![図_(参考情報)患者報告アウトカム(PRO)[副次評価項目]_悪化までの期間](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak200/lmk_codebreak200_fig07.png?h=1684&iar=0&w=4338&hash=BE256A0B72D0E4050AB5D8B36C2C74A5)
ベースラインからの変化
![図_(参考情報)患者報告アウトカム(PRO)[副次評価項目]_](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/lumakras/codebreak200/lmk_codebreak200_fig08.png?h=1505&iar=0&w=4352&hash=17C26AB4B9B320407B054AC7FD0F5345)
ドラッグ・インフォメーション3)
「警告・禁忌を含む注意事項等情報」等の改訂に十分ご留意ください。
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
-
References
- Paragraphde Langen AJ, et al. Lancet. 2023; 401: 733-746.(SOT00279)
- de Langen AJ, et al. Lancet. 2023; 401: 733-746. Supplementary appendix.(SOT00287)
[利益相反:本試験はアムジェン社の支援により行われた。] - ルマケラスの電子化された添付文書第5版(2024年2月改訂)










