監修
川崎医科大学 血液内科学教室 教授
近藤 英生 先生
監修者の所属・役職は2024年3月時点の情報です
はじめに
2019年、微小残存病変(MRD)測定が一般臨床において急性リンパ性白血病(ALL)の初発時と再発時にそれぞれ保険診療として実施できるようになりました。現在MRD測定には様々な方法があり、標的や対象割合、保険適応の算定方法などがそれぞれ異なっています。そこで今回は、定量PCRとマルチパラメーターフローサイトメトリー(MFC)を用いたMRD測定についてご紹介します。
MRD測定法の比較
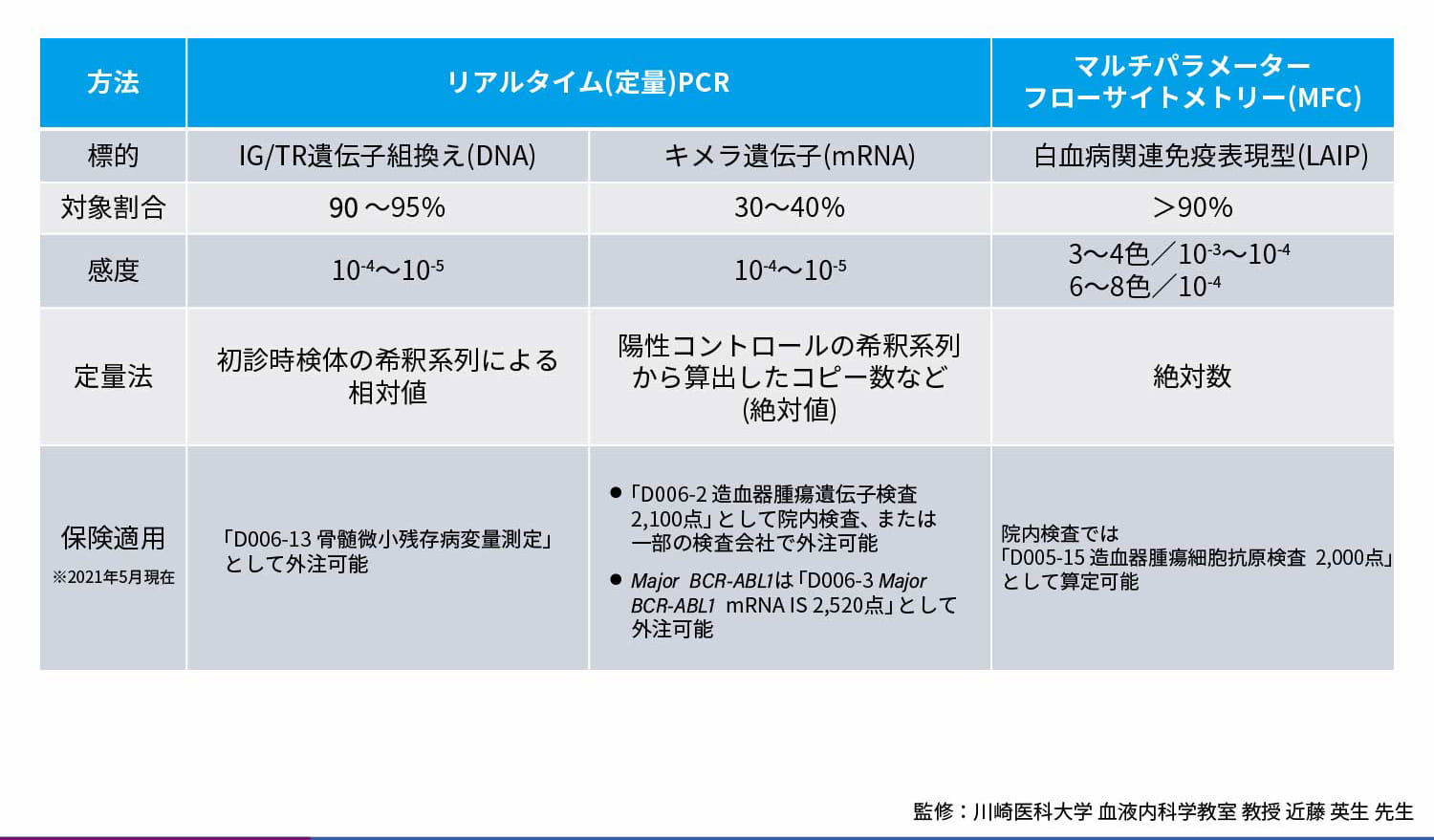
MRD測定法のメリット・デメリット

患者特異的免疫グロブリン(IG)/T細胞レセプター(TR)遺伝子再構成を標的とした定量PCR
ALLの白血病細胞では、IG遺伝子やTR遺伝子が再構成されています。クローナルな白血病細胞において組み替えられたIG/TR遺伝子のV(D)Jの使用部位、および結合部分の欠失/挿入は同一かつ特異的であるため1)、TG/TR遺伝子のV(D)J部分を解析し、この部分に対する患者特異的(ASO)なプライマーを設計することによって、近傍のコンセンサス配列に対するプローブ、プライマーと合わせて104~105に1個の白血病細胞を検出可能なリアルタイムPCRが可能となります。
患者特異的免疫グロブリン/T細胞レセプター遺伝子再構成を標的とした定量PCR(IG/TR RQ-PCR)の原理
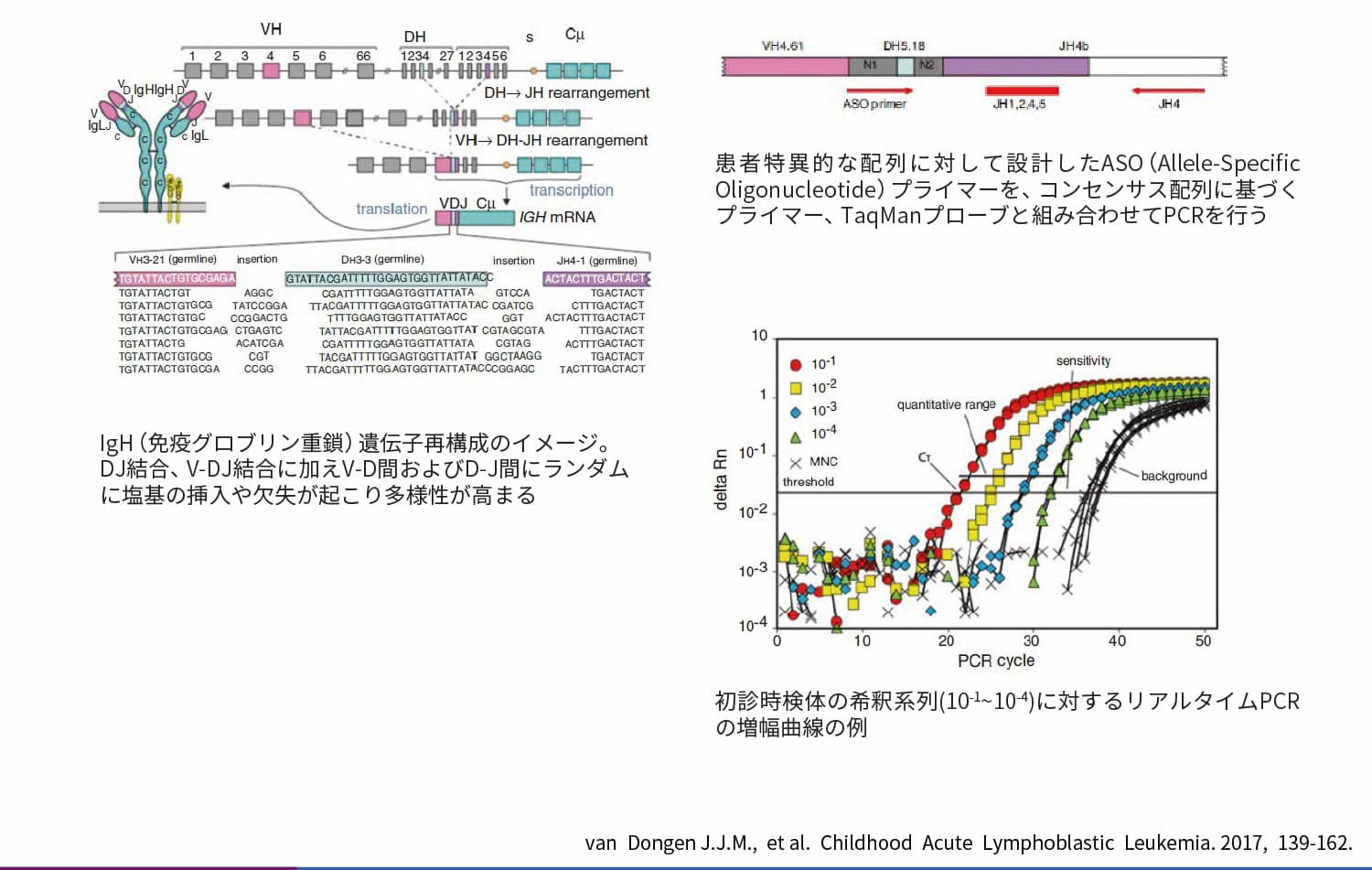
ただし、一部(5~10%)のALLではより未分化な細胞を起源としているためIG/TR遺伝子組換えが起こっていないことや、技術的な問題により、ASOプライマーの設計ができないことがあります2)。
また、再発時などASOプライマー設定部位の配列に変化が生じた場合には検出ができなくなる可能性があります。再発時に同じIG/TRにてMRD検出可能であったのは、BCP-ALLの約7割、T-ALLの約9割であったと報告されています3)。
日常臨床におけるIG/TR RQ-PCRの課題

平成30年4月に保険収載された「D006-13 骨髄微小残存病変量測定」は、この方法によるものです。2019年2月に衛生検査所2施設が学会認定され、外注検査として日常臨床での測定が可能となりました。
ただし、施設基準の届け出が必要であること、およびASOプライマーを作成する「遺伝子再構成の同定に用いるもの」は初発時、再発時にそれぞれ1回、微小残存病変を測定する「モニタリングに用いるもの」は初発時と再発時にそれぞれ2回までと算定回数が明記されています。
D006-13 骨髄微小残存病変量測定

キメラ遺伝子mRNAを対象とした定量RT-PCR
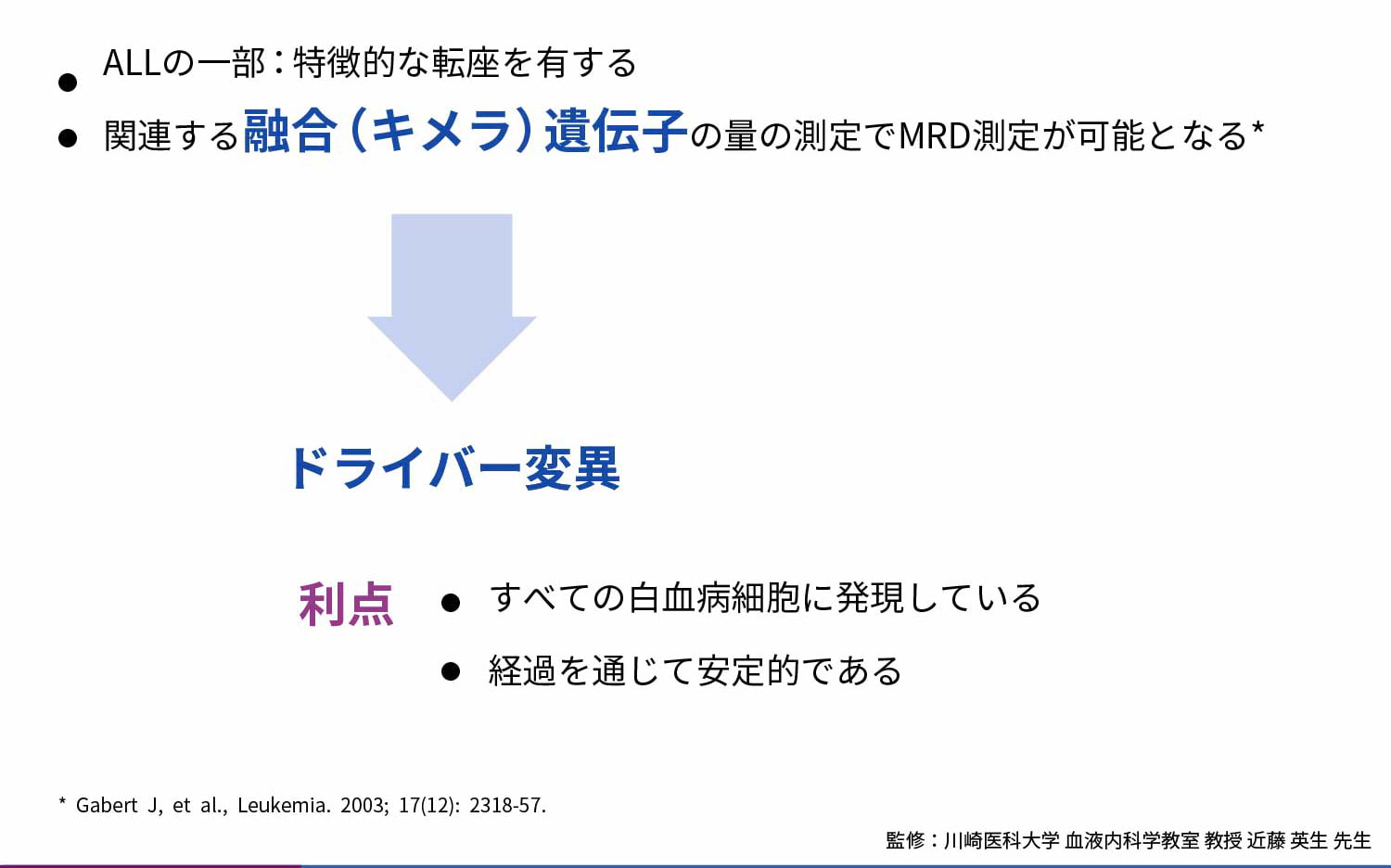
ALLの一部は特徴的な染色体転座を有しており、関連する融合遺伝子(キメラ遺伝子)の量を測定することでMRDを測定することができます4)。これらのキメラ遺伝子はドライバー変異であるためすべての白血病細胞に発現しており、かつ経過を通じて安定であるという利点があります。
キメラ遺伝子mRNAを対象とした定量RT-PCR①
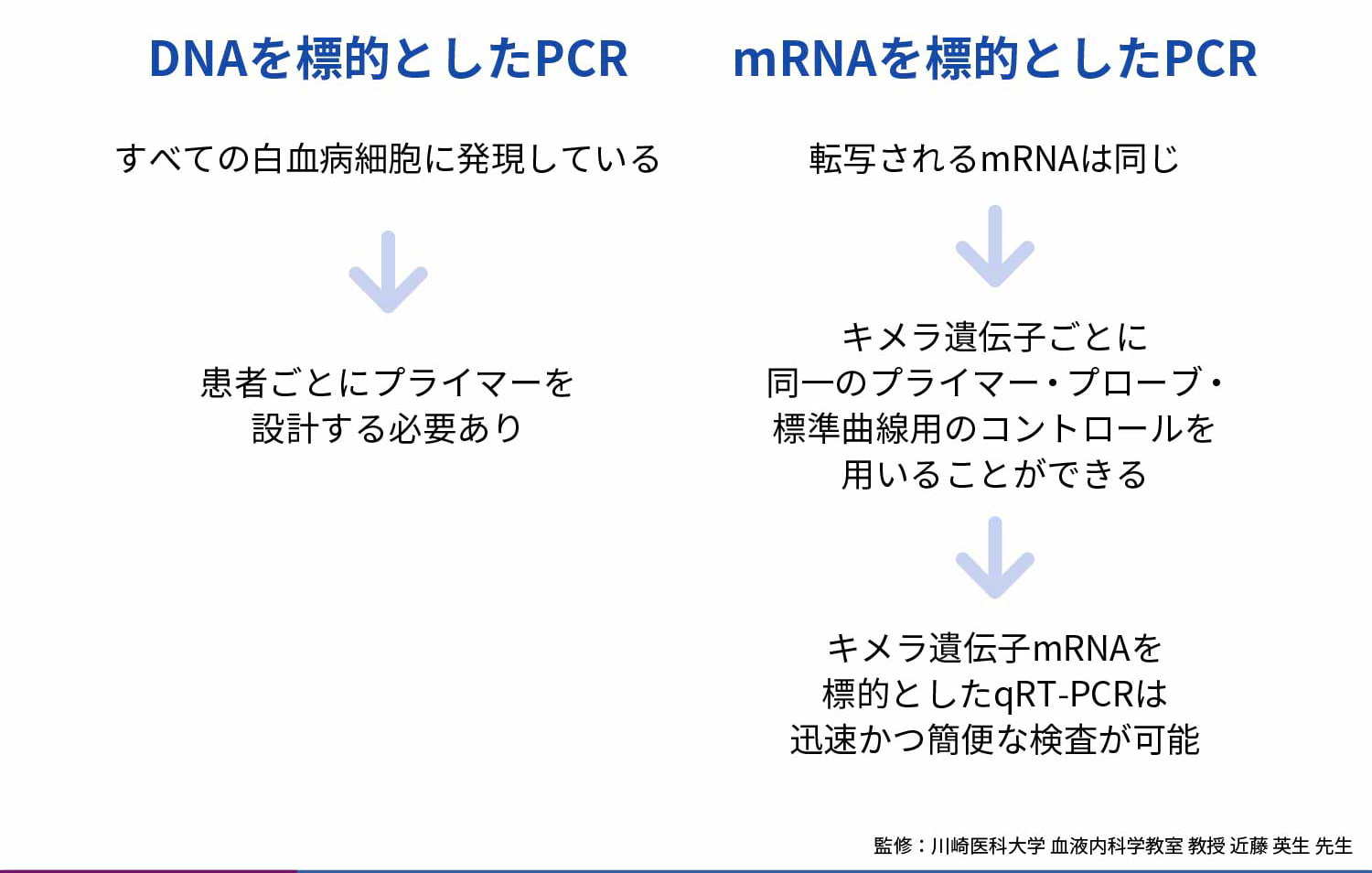
DNAの転座位置は同一ではないため、DNAを標的としたPCRでは患者ごとに転座位置を解析しプライマーを設計する必要がありますが、転写されるmRNAは同じであるため、mRNAを標的とする場合はキメラ遺伝子ごとに同一のプライマー、プローブ、および標準曲線用のコントロール(プラスミドなど)を用いることができ、迅速かつ簡便に検査可能です。
キメラ遺伝子mRNAを対象とした定量RT-PCR②
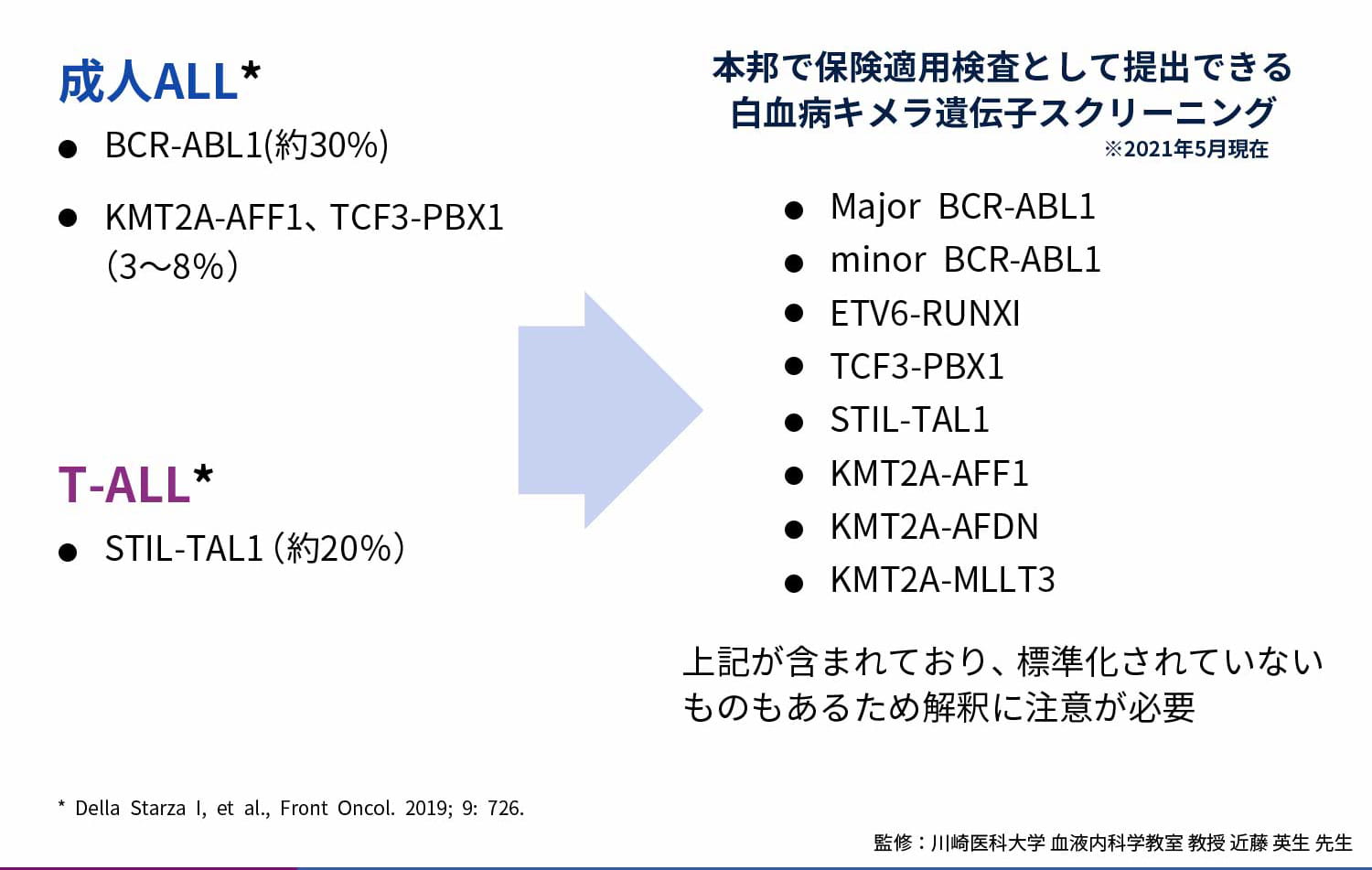
成人ALLにおいて最も頻度が高いのはBCR-ABL1(約30%)であり、T-ALLにおいては約20%がSIL-TAL1を有しています5)。
本邦で保険適用検査として提出できる白血病キメラ遺伝子スクリーニングにはMajor BCR-ABL1、minor BCR-ABL1、ETV6-RUNXI、TCF3-PBX1、STIL-TAL1、KMT2A-AFF1、KMT2A-AFDN、KMT2A-MLLT3が含まれており、標準化されていないものもあるため解釈に注意が必要です。
マルチパラメーターフローサイトメトリー(MFC)
白血病細胞の多くは、正常のTリンパ球、Bリンパ球とは異なる抗原を発現しており、この白血病関連免疫表現型(LAIP)を標的とすることで、マルチパラメーターフローサイトメトリー(MFC)によりMRDを評価することができます。
マルチパラメーターフローサイトメトリー(MFC)①

3~4種の抗体でのMFCは10-3~10-4程度の感度でしたが、6~8種の抗体を用いたMFCが用いられるようになり、10-4~10-5と高感度での測定が可能となりました6)。EuroFlowによりBCP-ALLに対するMFCの標準化が行われ、8種類の抗体×2本のパネル(CD20、CD45、CD81、CD34、CD19、CD10、CD34+CD66c/CD123またはCD73/CD304)により、十分量の細胞数(>4×106)があれば93%以上の患者においてPCRと同等の感度(≦10-5)でMRDを測定可能であることが報告されました7)。
日常診療において、ALLに対するMFCは、院内検査として行う場合のみ保険診療とできます。(2021年5月現在)
マルチパラメーターフローサイトメトリー(MFC)②

MRD測定検体の採取部位とタイミング
小児ALLのIG/TR RQ-PCRにおいて、T-ALLでは末梢血検体と骨髄検体の感度は同等、BCP-ALLでは末梢血検体の感度は骨髄検体より10~1,000倍低かったと報告されており8)、BCP-ALLでは骨髄検体によって測定する必要があると考えられます。また、成人ALLにおけるMRD測定のタイミングは明確ではありませんが、「D006-13 骨髄微小残存病変量測定」の「2.モニタリングに用いるもの」は、「初発時と再発時にそれぞれ2回を限度として算定できる」となっている(2021年5月現在)ことを考慮する必要があると考えられます。
MRD測定検体の採取部位とタイミング

今回は、IG/TR遺伝子再構成やキメラ遺伝子mRNAを標的とした定量PCR、およびMFCを用いたMRD測定についてご紹介しました。
本日ご紹介した内容を、先生方の日常診療にお役立ていただければ幸いです。
-
References
- van Dongen JJM, et al., Childhood Acute Lymphoblastic Leukemia. 2017; 139-62.
- Bruggemann M, et al., Blood. 2006; 107(3): 1116-23.
- Szczepa?ski T, et al., Leukemia. 2003; 17(11): 2149-56.
- Gabert J, et al., Leukemia. 2003; 17(12): 2318-57.
- Della Starza I, et al., Front Oncol. 2019; 9: 726.
- Denys B, et al., Leukemia. 2013; 27(3): 635-41.
- Theunissen P, et al., Blood. 2017; 129(3): 347-57.
- van der Velden VHJ, et al., Leukemia. 2002; 16(8):1432-6.


















