試験概要1-3)
目的
成人の再発又は難治性の Ph陰性B細胞性ALL患者におけるビーリンサイトの有効性及び安全性を、標準化学療法と比較評価する。
試験デザイン
非盲検、多施設共同[アジア、オーストラリア、欧州、中南米及び北米の21ヵ国、101施設]、ランダム化、第Ⅲ相試験
対象
成人の再発又は難治性のPh陰性B細胞性ALL患者405例
(ビーリンサイト群:271例、標準化学療法群:134例)
〔診断及び適格性の主な基準〕
- 18歳以上のPh陰性B細胞性ALL患者のうち、下記のいずれかに該当する患者
- 初回寛解導入療法又は救援療法で難治性と判断された患者
- 初回寛解期間12ヵ月以内に再発し、未治療であった患者
- 2回以上再発し、未治療であった患者
- 同種造血幹細胞移植(HSCT)実施後に再発した患者
- 骨髄中の芽球率が5%超の患者
- 米国東海岸がん臨床試験グループ(ECOG) performance status(PS)が2以下の患者
〔主な除外基準〕
- 重要な中枢神経系(CNS)の症状の現病歴がある患者
- CNS浸潤が判明している又は疑われる患者
- 活動性の急性移植片対宿主病(GVHD)、又は全身治療を必要とする活動性の慢性GVHD患者
投与方法
患者をビーリンサイト群又は標準化学療法群に2対1にランダムに割り付けた。
各群ともに、寛解導入療法として2サイクル投与し、骨髄中の芽球率5%以下が得られた場合には、地固め療法として最大3サイクルまで投与した。また、その後も骨髄中の芽球率5%以下が持続した場合には、維持療法として最大12ヵ月まで投与可能とした。
ビーリンサイト群における寛解導入療法期及び地固め療法期は、28日間の持続点滴静注と14日間の休薬を1サイクルとし、維持療法期は、28日間の持続点滴静注と56日間の休薬を1サイクルとした。1サイクル目の1~7日目は9μg/日、それ以降は28μg/日を投与した。
標準化学療法群においては、あらかじめ規定した以下の4種類のレジメンのうちのいずれかを治験担当医師が選択し、投与した。
- FLAG[フルダラビン、シタラビン(Ara-C)及び顆粒球コロニー刺激因子製剤の併用投与]を含む化学療法
- 大量Ara-C療法を含む化学療法
- 大量メトトレキサート療法を含む化学療法
- クロファラビン単独投与又はクロファラビンを含む化学療法
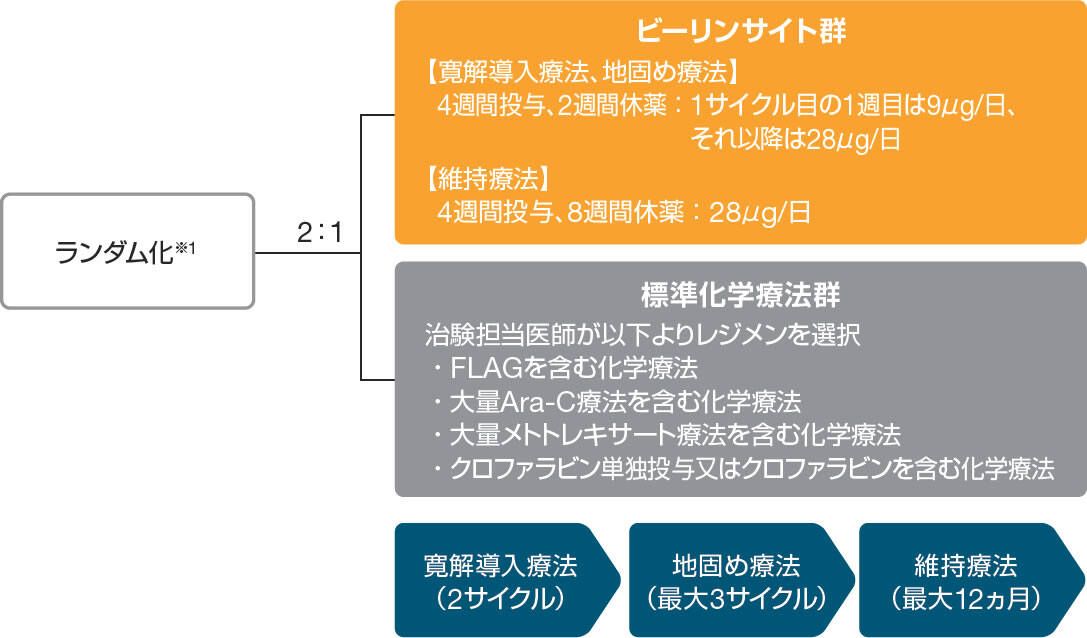
※1 層別因子:年齢(35歳未満又は35歳以上)、救援療法歴の有無、同種HSCT実施歴の有無
評価項目
主要評価項目(検証的項目):全生存期間(OS)
副次評価項目:投与開始後12週以内のCR率、投与開始後12週以内のCR/CRh*/CRi率、無イベント生存期間(EFS)、CR又はCR/CRh*/CRi持続期間、投与開始後12週以内の微小残存病変(MRD奏効率、同種HSCT実施率など
〔寛解の定義〕
- CR:骨髄芽球率が5%以下かつ末梢循環血中に白血病細胞が認められない状態で、造血の回復について、末梢血の血小板数100,000/μL超かつ好中球絶対数1,000/μL超
- CRh*:CRh*:骨髄芽球率が5%以下かつ末梢循環血中に白血病細胞が認められない状態で、造血の回復について、末梢血の血小板数50,000/μL超かつ好中球絶対数500/μL超
- CRi:骨髄芽球率が5%以下かつ末梢循環血中に白血病細胞が認められない状態で、造血の回復について、末梢血の血小板数100,000/μL超又は好中球絶対数1,000/μL超
- MRD奏効:PCR又はフローサイトメトリーで測定したMRD量が10-4未満
- MRD完全寛解:PCR又はフローサイトメトリー測定によるMRDが検出下限未満
解析計画
外部の独立データモニタリング委員会が、全死亡例数の約50%及び75%が発生した時点で正式な中間解析を計2回実施しOSを評価した。有効性主要解析は、FASを用いて実施した。また、FASのうち、治験薬が投与されなかった29例を除く376例(ビーリンサイト群267例、標準化学療法群109例)を安全性解析対象集団とした
OSは、ランダム化の際の層別因子により両側層別log-rank検定を用いて検定し、ビーリンサイト群のOSが標準化学療法群と比較して優れているか否かを判断した。
CR及びCR/CRh*/CRiに対する治療の効果は、ランダム化の際の層別因子※1で調整した両側Cochran-Mantel-Haenszel検定を用いて解析した。
多重性を調整するため、主要評価項目及び主な副次評価項目の統計的検定は以下の階層構造に従うよう事前規定された:①OS、②CR、③CR/CRh*/CRi、④EFS。OS及び投与開始後12週以内のCR/CRh*/CRi率は、あらかじめ解析計画で規定された患者背景で層別し部分集団解析を実施し、OSは、副次解析として移植実施時点で打ち切りとした場合についても評価した。
FAS:ランダムに割り付けられたすべての患者を対象とした。
本試験は、OSの第2回中間解析から、標準化学療法群に対するビーリンサイト群の優越性が検証されたことから、独立データモニタリング委員会より試験の早期有効中止が提言され、早期中止された。
患者背景 1,2)
|
ビーリンサイト群 (n=271) |
標準化学療法群 (n=134) |
|
|---|---|---|
| 性別、n(%) | ||
| 男性 女性 |
162 (59.8%) 109(40.2%) |
77(57.5%) 57(42.5%) |
| 年齢中央値、歳(範囲) | 37.0 (18-80) | 37.0 (18-78) |
| 年齢、n(%) | ||
|
35歳未満 35~55歳未満 55~65歳未満 65歳以上 |
124 (45.8%) 80(29.5%) 34(12.5%) 33(12.2%) |
60(44.8%) 33(24.6%) 26(19.4%) 15(11.2%) |
| 主な患者選択基準、n(%) | ||
|
初回寛解導入療法又は救援療法で難治性 初回寛解期間12ヵ月未満で再発 2回以上再発※2 同種HSCT実施後に再発※3 いずれにも該当しない |
115 (42.4%) 76(28.0%) 32(11.8%) 46(17.0%) 2(0.7%) |
54 (40.3%) 37(27.6%) 16(11.9%) 27(20.1%) 0 |
| 同種HSCT実施歴あり、n(%) | 94 (34.7%) | 46 (34.3%) |
| 本試験で受ける救援療法、n (%) | ||
|
1回目 2回目 3回目 4回目 5回目以上 |
114(42.1%) 91(33.6%) 45(16.6%) 14(5.2%) 7(2.6%) |
65 (48.5%) 43(32.1%) 16(11.9%) 5(3.7%) 5(3.7%) |
| 骨髄中/末梢血中の芽球率の最大値、n(%) | ||
|
5%以下 5%超10%未満 10%以上50%未満 50%以上 不明 |
0 9(3.3%) 60(22.1%) 201(74.2%) 1(0.4%) |
0 7(5.2%) 23(17.2%) 104(77.6%) 0 |
※2 主な患者選択基準のうち、「初回寛解導入療法又は救援療法で難治性」、「初回寛解期間12ヵ月未満で再発」に該当しない患者
※3 主な患者選択基準のうち、「初回寛解導入療法又は救援療法で難治性」、「初回寛解期間12ヵ月未満で再発」、「2回以上再発」に該当しない患者
結果
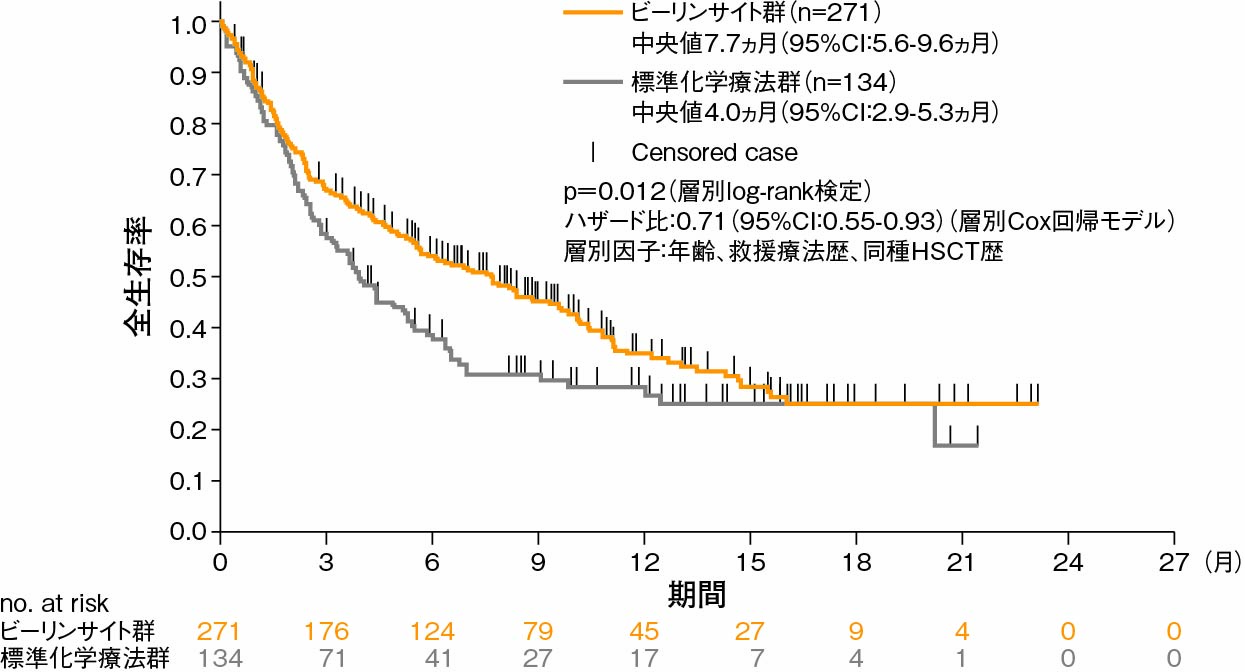
主要評価項目(検証的項目):OS1)
FASにおけるOSの中央値は、ビーリンサイト群で7.7ヵ月(95%CI:5.6-9.6ヵ月)、標準化学療法群で4.0ヵ月(95%CI:2.9-5.3ヵ月)であった。ビーリンサイト群では、標準化学療法群に比べて死亡リスクの29%低下が認められ、OSにおいて、標準化学療法群に対するビーリンサイト群の優越性が検証された(p=0.012、層別log-rank検定)。
Kaplan-Meier法によるOS(FAS)(検証的項目)
本試験で受ける救援療法の実施回数別OS(サブグループ解析)※4、3)
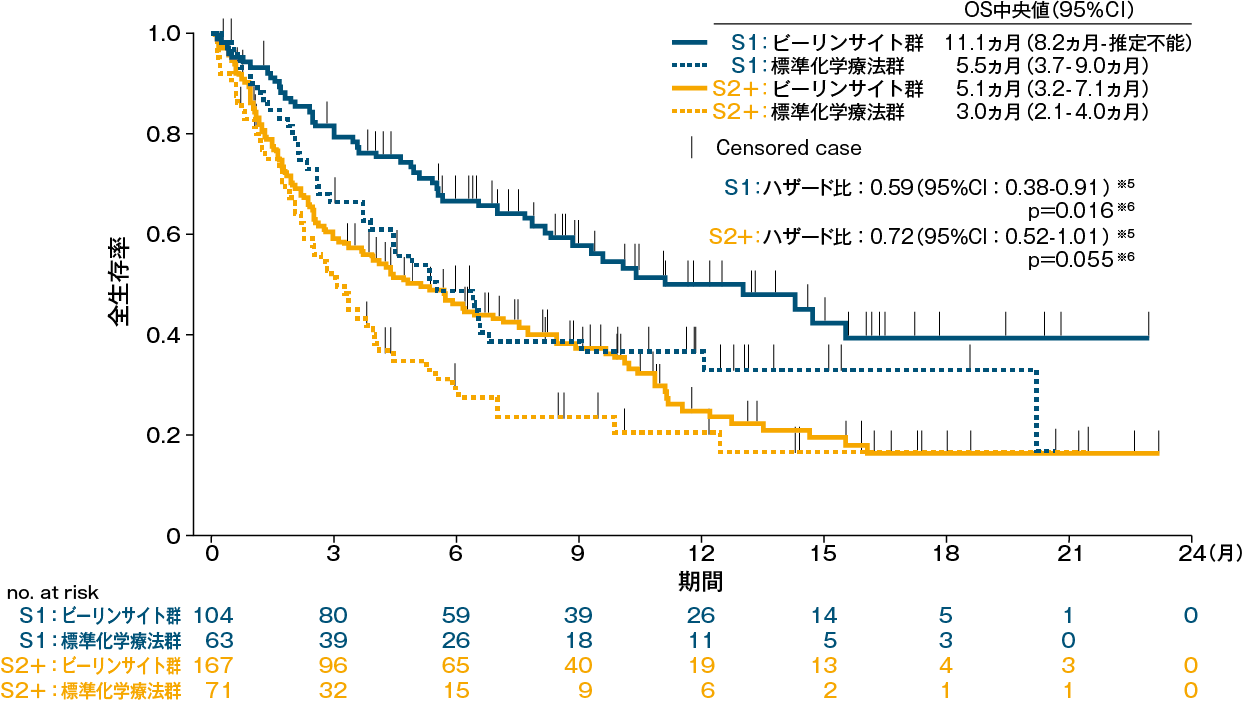
S1:本試験で受ける救援療法が1回目、 S2+:本試験で受ける救援療法が2回目以上
評価方法:あらかじめ解析計画で規定された、本試験で受ける救援療法の実施回数(1回目又は2回目以上)別に患者を層別し、OS(ランダム化から死因を問わない死亡までの期間)をKaplan-Meier法で推定し、両側層別log-rank検定#を用いて比較した※4。
※4 救援療法の実施回数について、文献2)の層別変数と担当医から報告されたデータに差が認められたことから、本解析では専門家による再判定を行った
※5 層別Cox回帰モデル#
※6 名目上のp値、層別log-rank検定#
# 層別因子:年齢、救援療法歴、同種HSCT歴
OS:サブグループ解析2)
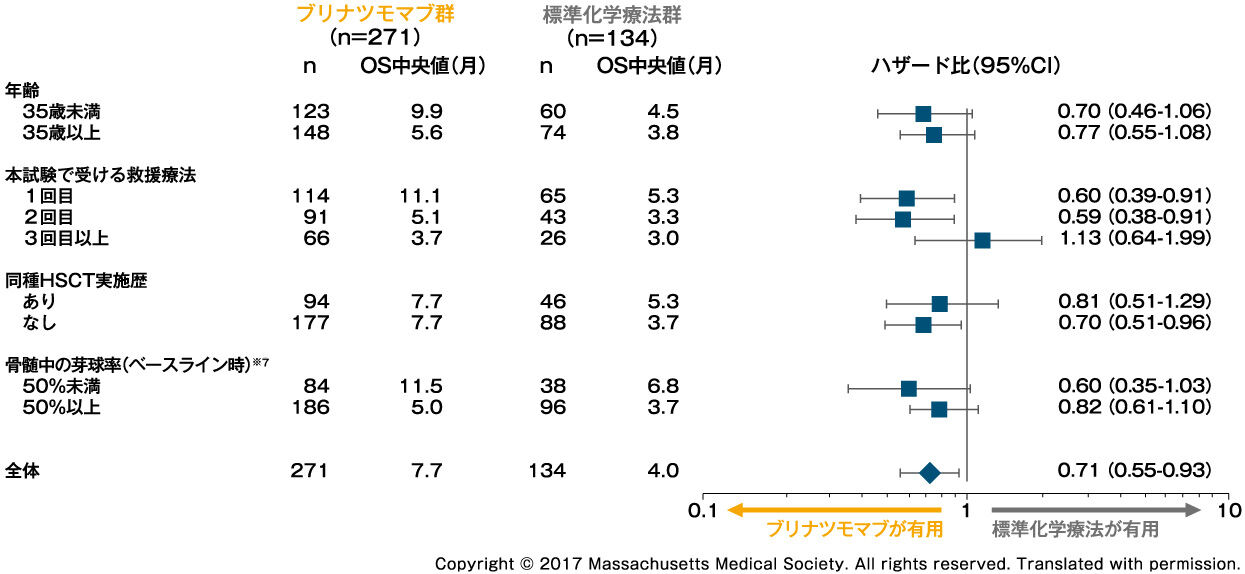
評価方法:Cox回帰モデルにより、あらかじめ解析計画で規定された患者背景(年齢、本試験で受ける救援療法及び同種HSCT実施歴など)で層別化し、部分集団解析を実施した。
※7 ベースライン時の骨髄所見はセントラル・ラボ又は施設の検査室の評価を用いた。ブリナツモマブ群の1例はセントラル・ラボ、施設の検査室のいずれでも骨髄所見が得られなかった
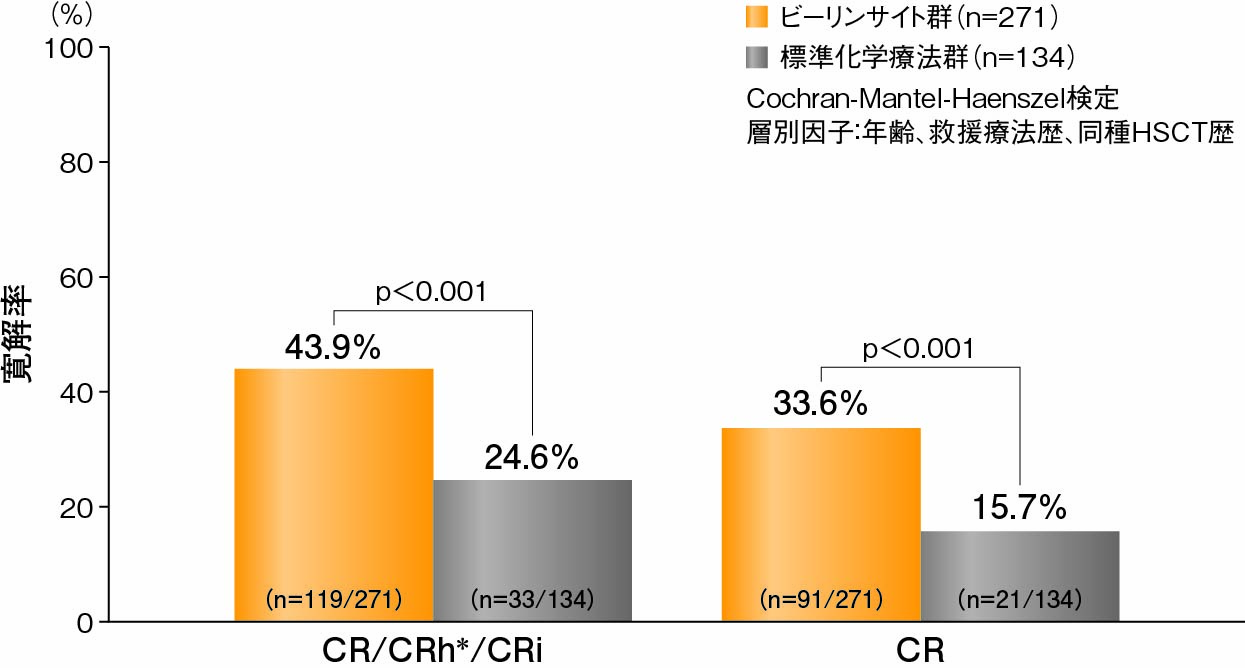
副次評価項目:投与開始後12週以内のCR率及びCR/CRh*/CRi率1)
投与開始後12週以内のCR率は、ビーリンサイト群が33.6%(91/271例、95%CI:28.0%-39.5%)、標準化学療法群が15.7%(21/134例、95%CI:10.0%-23.0%)であり、ビーリンサイト群が有意に高かった(p<0.001、Cochran-Mantel-Haenszel検定)。
また、投与開始後12週以内のCR/CRh*/CRi率は、ビーリンサイト群が43.9%(119/271例、95%CI:37.9%-50.0%)、標準化学療法群が24.6%(33/134例、95%CI:17.6%-32.8%)であり、ビーリンサイト群が有意に高かった(p<0.001、Cochran-Mantel-Haenszel検定)。
投与開始後12週以内のCR率及びCR/CRh*/CRi率(FAS)
副次評価項目:EFS1)
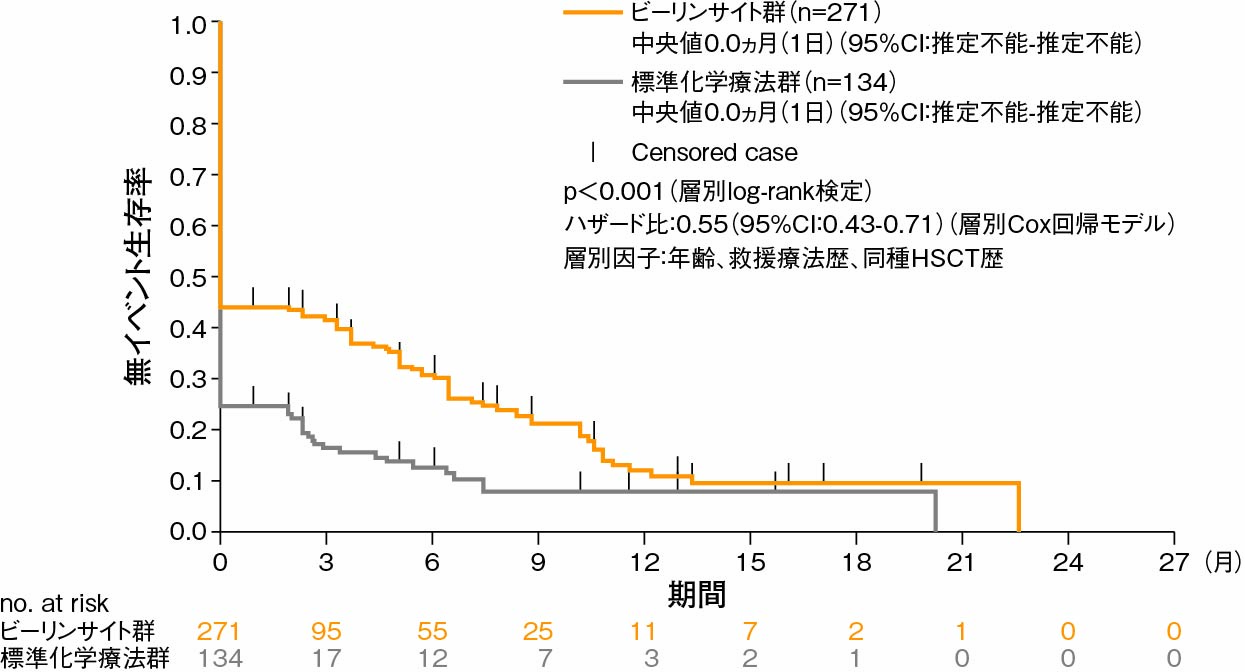
イベント(無効、再発、全死因死亡など)の発現率は、標準化学療法群(88.8%)がビーリンサイト群(77.1%)と比べて高かった。ビーリンサイト群では、標準化学療法群に比べてイベントの発現リスクの45%低下が認められた(p<0.001、層別log-rank検定)。
Kaplan-Meier法によるEFS(FAS)
副次評価項目:CR又はCR/CRh*/CRi持続期間1)
寛解例におけるCR持続期間(イベント発生までの期間)の中央値は、ビーリンサイト群で8.3ヵ月(95%CI:5.7-10.7ヵ月)、標準化学療法群で7.8ヵ月(95%CI:2.2-19.0ヵ月)であった。また、CR/CRh*/CRi持続期間の中央値は、ビーリンサイト群で7.3ヵ月(95%CI:5.8-9.9ヵ月)、標準化学療法群で4.6ヵ月(95%CI:1.8-19.0ヵ月)であった。
CR持続期間(中央値)
| 期間中央値(95%CL) | |
|---|---|
| ビーリンサイト群(n=91) | 8.3ヵ月(5.7-10.7) |
| 標準化学療法群(n=21) | 7.8カ月(2.2-19.0) |
CR/CRh*/CRi持続期間(中央値)
| 期間中央値(95%CL) | |
|---|---|
| ビーリンサイト群(n=119) | 7.3ヵ月(5.8-9.9) |
| 標準化学療法群(n=33) | 4.6カ月(1.8-19.0) |
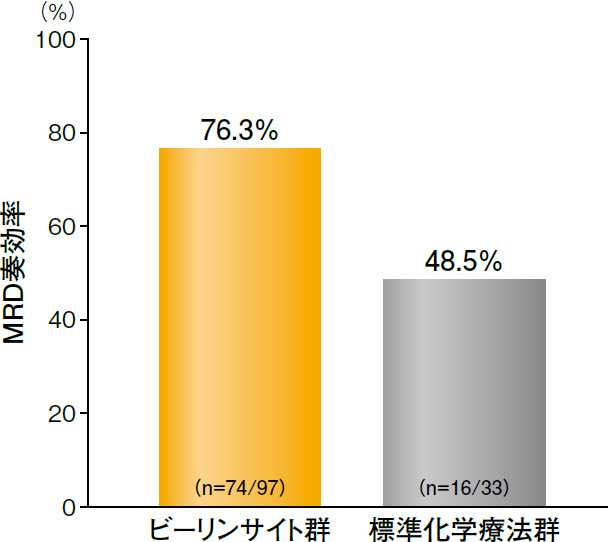
副次評価項目:投与開始後12週以内のMRD奏効率1)
計235例でMRDの評価が行われた。投与開始後12週以内のMRD奏効率は、ビーリンサイト群76.3%(74/97例)、標準化学療法群48.5%(16/33例)であり、ビーリンサイト群の方が高値であった(95%CI:8.8%-46.8%)。
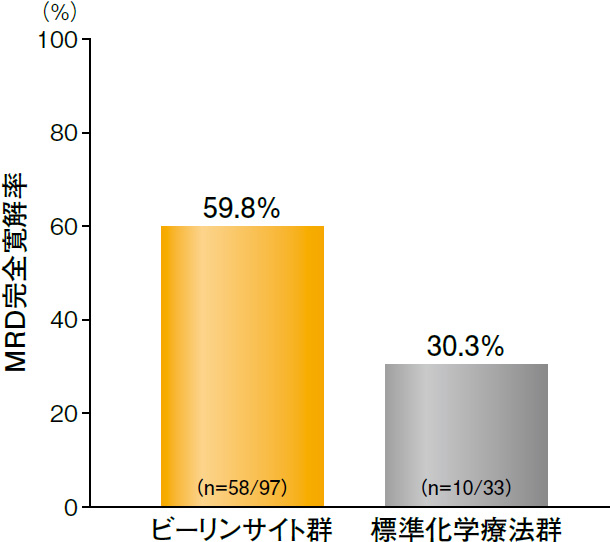
また、MRD完全寛解率は、ビーリンサイト群59.8%(58/97例)、標準化学療法群30.3%(10/33例)であり、ビーリンサイト群の方が高値であった(95%CI:11.0%-48.0%)。
MRD奏効率
MRD完全寛解率
副次評価項目:同種HSCT実施率1)
同種HSCT実施率は、ビーリンサイト群24.0%(65/271例)、標準化学療法群23.9%(32/134例)であった
安全性
有害事象は、ビーリンサイト群で98.5%(263/267例)、標準化学療法群で99.1%(108/109例)に認められ、治験薬との因果関係が否定できない有害事象はそれぞれ80.1%(214/267例)、84.4%(92/109例)に認められた。主な有害事象は、ビーリンサイト群では発熱159例(59.6%)及び頭痛79例(29.6%)であり、標準化学療法群では発熱49例(45.0%)、貧血及び悪心各46例(各42.2%)であった。
重篤な有害事象は、ビーリンサイト群で62.9%(168/267例)、標準化学療法群で45.0%(49/109例)で発現した。主な事象は、ビーリンサイト群では発熱性好中球減少症24例(9.0%)及び発熱16例(6.0%)、標準化学療法群で発熱性好中球減少症12例(11.0%)及び敗血症7例(6.4%)であり、うち、ビーリンサイト群の発熱性好中球減少症11例及び発熱6例、標準化学療法群の発熱性好中球減少症11例及び敗血症5例は、治験薬との因果関係が否定されなかった
投与中止に至った有害事象は、ビーリンサイト群で15.7%(42/267例)、標準化学療法群で9.2%(10/109例)で発現した。ビーリンサイト群では気管支肺アスペルギルス症、真菌性敗血症、貪食細胞性組織球症、呼吸不全及び敗血症性ショックが各2例に認められ、うち、呼吸不全2例、気管支肺アスペルギルス症及び貪食細胞性組織球症各1例では本剤との因果関係が否定されなかった。標準化学療法群では無顆粒球症、発熱性好中球減少症、下痢、発熱、肝障害、腸球菌性菌血症、腸球菌感染、歯周炎、敗血症性ショック、全身性カンジダ、意識変容状態、急性腎障害、呼吸不全、肺水腫が各1例に認められた。本試験において、投与期間中又は投与終了後30日以内の死亡は、ビーリンサイト群71例、標準化学療法群22例に認められた。
主な死因は、ビーリンサイト群で疾患進行23例、敗血症/疾患進行及び敗血症性ショック各5例であり、標準化学療法群では、疾患進行及び敗血症各4例であった。このうち、ビーリンサイト群の急性呼吸不全/疾患進行、細菌感染、気管支肺アスペルギルス症、好中球減少性敗血症、肺炎、呼吸不全、敗血症及び敗血症症候群各1例、標準化学療法群の敗血症2例、急性腎障害/疾患進行、菌血症、腸球菌感染、真菌性肺炎及びシュードモナス感染各1例では、治験薬との因果関係が否定されなかった。
-
References
- 承認時評価資料:0010
3311試験 海外第Ⅲ相試験/BLI90006/DIR180239 - Kantarjian H et al. N Engl J Med 2017; 376: 836-847/BLI00001/BLC-00055
利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。 - Dombret H et al. Leuk Lymphoma 2019; 60: 2214
-2222
利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。 - Topp MS et al. Blood 2018; 131: 2906
-2914
利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。
- 承認時評価資料:0010











