第Ⅰb相パートの結果のみを示す。
試験概要
目的
日本人成人及び小児の再発又は難治性のB細胞性ALL患者におけるビーリンサイトの推奨用量、有効性、安全性を評価する。
試験デザイン
非盲検、多施設共同[日本16施設]、単群、第Ⅰb/Ⅱ相試験
対象
日本人成人及び小児の再発又は難治性のB細胞性ALL患者14例(成人5例、小児9例)
〔診断及び適格性の主な基準〕
- 18歳以上のPh陰性B細胞性ALL患者のうち、下記のいずれかに該当する患者
一次治療後に再発又は難治性と判断され、初回寛解期間が12ヵ月以下の患者
初回救援療法後に再発又は難治性と判断された患者
同種造血幹細胞移植(HSCT)実施後12ヵ月以内に再発又は難治性と判断された患者 - 骨髄中の芽球率が5%超の患者
- 米国東海岸がん臨床試験グループ(ECOG)performance status(PS)が2以下の患者
- 18歳未満の再発又は難治性のB細胞性ALLの患者のうち、下記のいずれかに該当する患者
2回目以降の骨髄再発である患者
同種HSCT実施後に骨髄再発した患者
他の治療に難治性と判断された患者
初回再発患者:2回目の十分な治療強度を有する標準再寛解導入化学療法で寛解に達しなかった患者
初回寛解に達しなかった患者:十分な治療強度を有する標準寛解導入化学療法で寛解に達しなかった患者 - 骨髄中の芽球率が5%超の患者
- Karnofsky PSが50%以上(16歳以上の場合)又はLansky PSが50%以上(16歳未満の場合)の患者
成人
小児
〔主な除外基準〕
本治験治療開始前5年以内に治験実施計画書に規定したALL以外の悪性腫瘍の既往歴、バーキット白血病の診断又は孤立性髄外病変を有する患者
投与方法
ビーリンサイトは、28日間の持続点滴静注と14日間の休薬を1サイクルとし、最大5サイクルまで投与した(最初の2サイクル以内に骨髄中の芽球率5%以下が得られた場合には最大3サイクルまで追加可能とした)。
第Ⅰb相パートでは、成人には1サイクル目の1~7日目は9μg/日、それ以降は28μg/日、小児には1サイクル目の1~7日目は5μg/m2/日、それ以降は15μg/m2/日を投与し、用量制限毒性(DLT)に基づき最大耐量(MTD)を決定した。DLTが2例以上発現した場合には減量した。
MTDは、DLTを発現した患者が6例中1例以下であった場合の最大投与量を選択した。
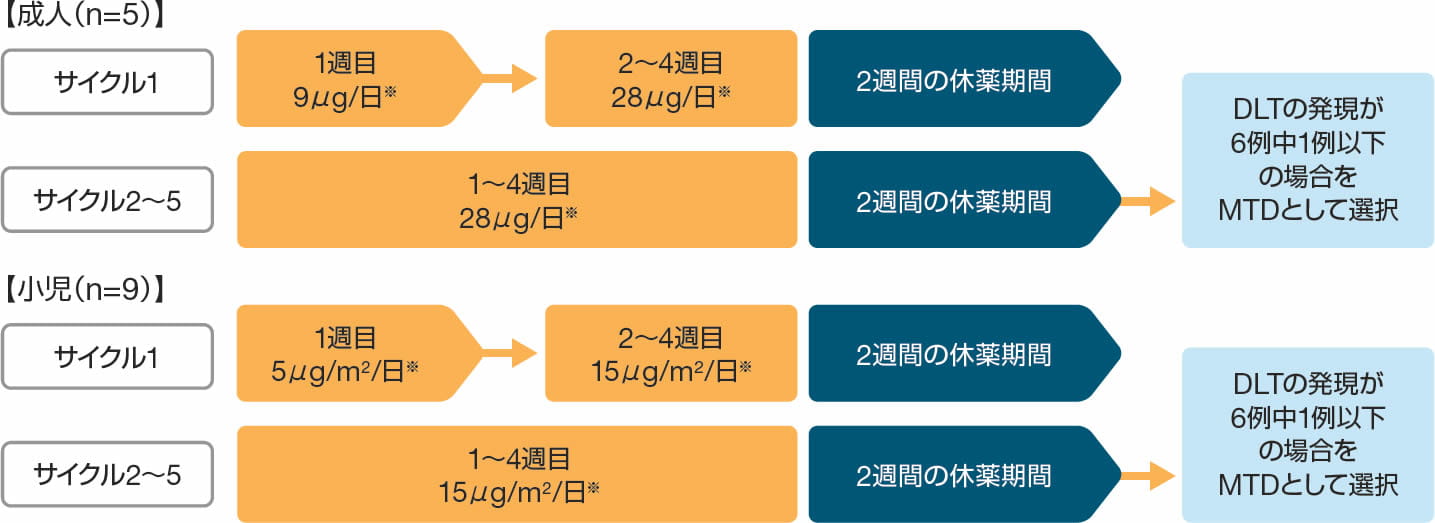
※DLTが2例以上発現した場合、減量した。
評価項目
主要評価項目:DLTの発現率
副次評価項目:最初の2サイクル以内のCR/CRh*率(成人)、最初の2サイクル以内の骨髄M1寛解率(小児)、血液学的再発までの期間(TTHR)、無再発生存期間(RFS)、全生存期間(OS)など
探索的評価項目:微小残存病変(MRD)奏効率、MRD完全寛解率など
〔寛解の定義〕
- CR:骨髄芽球率が5%以下かつ末梢循環血中に白血病細胞が認められない状態で、造血の回復について、末梢血の血小板数100,000/μL超かつ好中球絶対数1,000/μL超
- CRh*:骨髄芽球率が5%以下かつ末梢循環血中に白血病細胞が認められない状態で、造血の回復について、末梢血の血小板数50,000/μL超かつ好中球絶対数500/μL超
- 骨髄M1寛解:骨髄芽球率が5%以下かつ末梢循環血中に白血病細胞が認められない状態で、造血の回復(末梢血の血小板数及び好中球絶対数)は問わない
- MRD完全寛解:PCR(最小10-4の検出感度及び定量測定範囲のアッセイ)で白血病細胞が検出されない状態
また、骨髄M1寛解は下記に細分類した。
- 末梢血球数の完全な回復を伴う骨髄M1(末梢血の血小板数100,000/μL超かつ好中球絶対数1,000/μL超)
- 末梢血球数の回復が不十分な骨髄M1(末梢血の血小板数50,000/μL超かつ100,000/μL以下、及び好中球絶対数500/μL超かつ1,000/μL以下)
- 末梢血球数の完全又は不十分な回復を伴わない骨髄M1
解析計画
有効性評価解析はFASを用いて実施した。CR、CRh*、骨髄M1寛解以外の最良効果についても、効果カテゴリー別に要約した。
解析可能な例数の場合、OS及びRFSをKaplan-Meier法を用いて推定することとした。
FAS(最大の解析対象集団):ビーリンサイトを1回以上投与されたすべての患者を対象とした。
患者背景
【成人】
性別は女性がほとんどであり(4/5例)、年齢の中央値は58.0歳(範囲:23-75歳)であった。成人患者のいずれもALLの再発に関連する遺伝子異常を有しておらず、5例中1例が中枢神経系(CNS)又は精巣以外の身体部位で髄外病変を有していた。また、5例中4例に同種HSCT実施歴があった。
【小児】
性別は男女でほぼ同じ割合であり(女性;5/9例)、年齢の中央値は11.0歳(範囲:7-17歳)であった。小児患者9例中2例がALLの再発に関連する遺伝子異常を有しており、いずれも低二倍体を有していた。9例中1例がCNS又は精巣以外の身体部位で髄外病変を有していた。また、9例中6例に同種HSCT実施歴があった。
結果
主要評価項目:DLTの発現率
第Ⅰb相パートのDLTの評価期間において、成人及び小児のいずれにおいても、DLTを発現した患者は認められなかった。
副次評価項目:最初の2サイクル以内のCR/CRh*率(成人)
最初の2サイクル以内にCR/CRh*が得られた患者は5例中4例であり、3例がCR、1例がCRh*であった。
成人における最初の2サイクル以内の血液学的最良効果(FAS)
| (n=5) | |
|---|---|
| CR/CRh*、n | 4 |
| CR | 3 |
| CRh* | 1 |
副次評価項目:最初の2サイクル以内の骨髄M1寛解率(小児)
最初の2サイクル以内に骨髄M1寛解が得られた患者は9例中5例であり、4例が末梢血球数の完全な回復を伴う骨髄M1、1例が末梢血球数の完全又は不十分な回復を伴わない骨髄M1であった。
小児における最初の2サイクル以内の血液学的最良効果(FAS)
| (n=9) | |
|---|---|
| 骨髄M1寛解、n | 5 |
| 末梢血球数の完全な回復を伴う骨髄M1 | 4 |
| 末梢血球数の回復が不十分な骨髄M1 | 0 |
| 末梢血球数の完全又は不十分な回復を伴わない骨髄M1 | 1 |
| 部分寛解、n | 1 |
| 安定、n | 1 |
| 病勢進行、n | 2 |
その他の副次評価項目
中間解析では、症例数が少なかったため有効性の副次評価項目を要約せず、統計的解析を実施しなかった。
【成人】
最初の2サイクル以内にCR/CRh*が得られた4例のうち、1例は再発なく生存(5.6ヵ月で打ち切り)、1例は他の原因により死亡(9.9ヵ月で打ち切り)、1例は4.2ヵ月で再発しその後死亡、残り1例は病勢進行により13.0ヵ月で死亡した。OSについては、1例がデータカットオフ時点で生存しており、4例がそれぞれ9.3、10.2、11.0及び13.9ヵ月で死亡した。
【小児】
最初の2サイクル以内に骨髄M1寛解が得られた5例のうち、2例は再発なく生存(0.0及び4.9ヵ月で打ち切り)、3例はそれぞれ1.1、1.4及び2.3ヵ月で再発し、再発した1例(2.3ヵ月で再発)はその後死亡した。OSについては、6例がデータカットオフ時点で生存し、3例がそれぞれ0.9、4.6及び8.4ヵ月で死亡した。
探索的評価項目
【成人】
最初の2サイクル以内にCR/CRh*が得られた4例からベースライン後に評価可能なMRD検体が得られ、いずれの患者でもMRD完全寛解が得られた。
【小児】
最初の2サイクル以内に骨髄M1寛解が得られた1例からベースライン後に評価可能なMRD検体が得られ、本患者においてMRD完全寛解が得られた。
安全性
有害事象は全例に認められ、治験薬との因果関係が否定できない有害事象は成人患者で全例、小児患者で88.9%(8/9例)に認められた。主な有害事象は、成人患者ではサイトカイン放出症候群4例(80.0%)及び頭痛3例(60.0%)、小児では発熱7例(77.8%)、発熱性好中球減少症、好中球減少症、サイトカイン放出症候群、低アルブミン血症、嘔吐及びALT増加各5例(各55.6%)であった。
重篤な有害事象は、成人には認められず、小児の11.1%(1/9例)で発現し、その事象は出血性ショックであり、本剤との因果関係が否定された。
投与中止に至った有害事象は、成人には認められず、小児の11.1%(1/9例)で発現し、その事象は白血病髄外浸潤であり、本剤との因果関係が否定されなかった。
本試験において、投与期間中又は投与終了後30日以内の死亡は小児の1例に認められた。死因は、出血性ショック/疾患進行であり、本剤との因果関係が否定された。
-
References
- 承認時評価資料:20130265試験 日本人第Ⅰb/Ⅱ相試験/BLI90005/DIR180238











