監修
北海道大学大学院 医学研究院 内科系部門 内科学分野
血液内科学教室 教授
豊嶋 崇徳 先生
監修者の所属・役職は2024年6月時点の情報です
T細胞を利用した免疫療法の登場
現在ALLの領域では、二重特異性T細胞誘導抗体(BiTE®抗体)をはじめとした自己のT細胞を利用する免疫療法が登場し、治療法は多様化しています。こうした新規治療は、65歳以上の高齢者など、移植や化学療法に不耐のALL患者に対する新たな選択肢にもなりうる可能性があると考えられます。
BiTE®抗体であるビーリンサイトは、CD19およびCD3の両方に特異性をもちます。65歳以上の高齢者を含む再発または難治性B細胞性ALL患者を対象としたビーリンサイトの海外第Ⅲ相比較対照臨床試験(TOWER試験)では、主要評価項目である全生存期間において、標準化学療法群に対するビーリンサイト群の優越性が検証されており1)、実臨床における有用性が注目されています。一方で、ビーリンサイトではサイトカイン放出症候群(cytokine release syndrome: CRS)や神経学的事象といった特徴的な有害事象が報告されており1)、実臨床での使用拡大に向けて、こうした有害事象の適切な評価・管理法の確立が求められています。
CRSおよび神経学的事象の発現頻度とグレード分類
CTCAE ver.5.0におけるCRSと痙攣発作のグレード分類※

CRS は、エフェクターT細胞が高度に活性化され、通常生体で生じるレベルを超える量のサイトカインが産生されることで引き起こされます2)。神経学的事象は、CAR-T細胞療法ではCRSと関連して発現する3,4)場合が多い一方、関連なく発症する場合もあり、より多彩な発現メカニズムが想定されます。
今までにCAR-T細胞療法後のCRSのさまざまな重症度分類が提案されてきましたが、その統一が課題でした5-7)。
そこで、American Society for Transplantation and Cellular Therapy(ASTCT)は、CAR-T細胞療法のみならずビーリンサイトなどT細胞を利用する免疫療法に共通の重症度分類ができるCRSや免疫エフェクター細胞関連神経学的事象を提唱しました。ビーリンサイトの臨床試験の際には、CRSおよび神経学的事象の重症度評価にがん化学療法の際に用いられる有害事象の評価Common Terminology Criteria for Adverse Events(CTCAE)が用いられましたが、今後はASTCT基準を用いることが理にかなっています。
ASTCTコンセンサスにおけるCRSのグレード分類
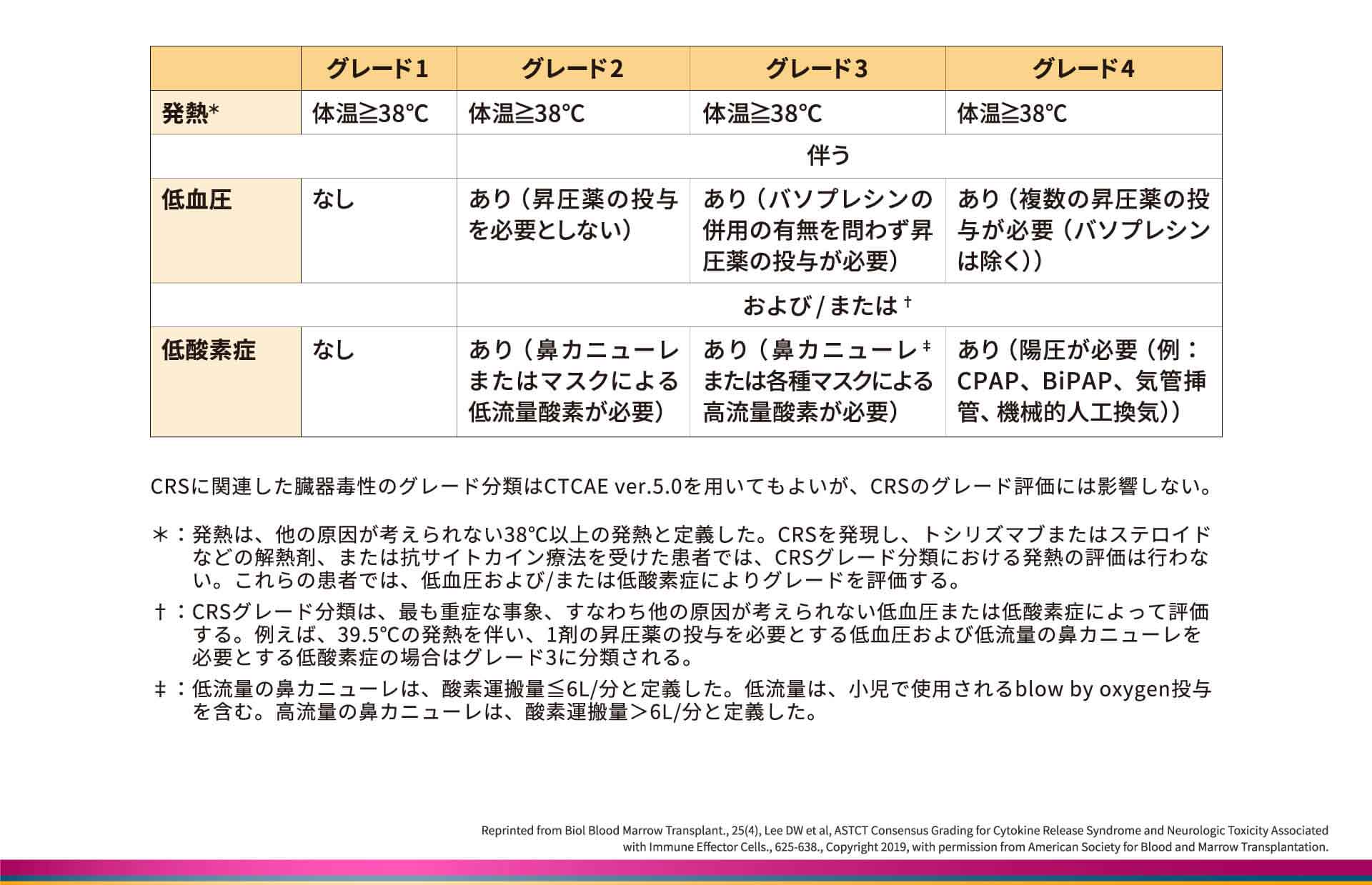
本コンセンサスでは、CRSのグレードについて、発熱、低血圧、低酸素症の有無や程度で評価します8)。38℃以上の発熱があり、昇圧薬の投与および/または高流量の鼻カニューレなどを必要とする低酸素症が認められる場合をグレード3、38℃以上の発熱に加えて、複数の昇圧薬の投与および/または持続陽圧呼吸(CPAP)などの処置を必要とする場合をグレード4と定義しています。
ASTCTコンセンサスにおけるICANSのグレード分類(成人)
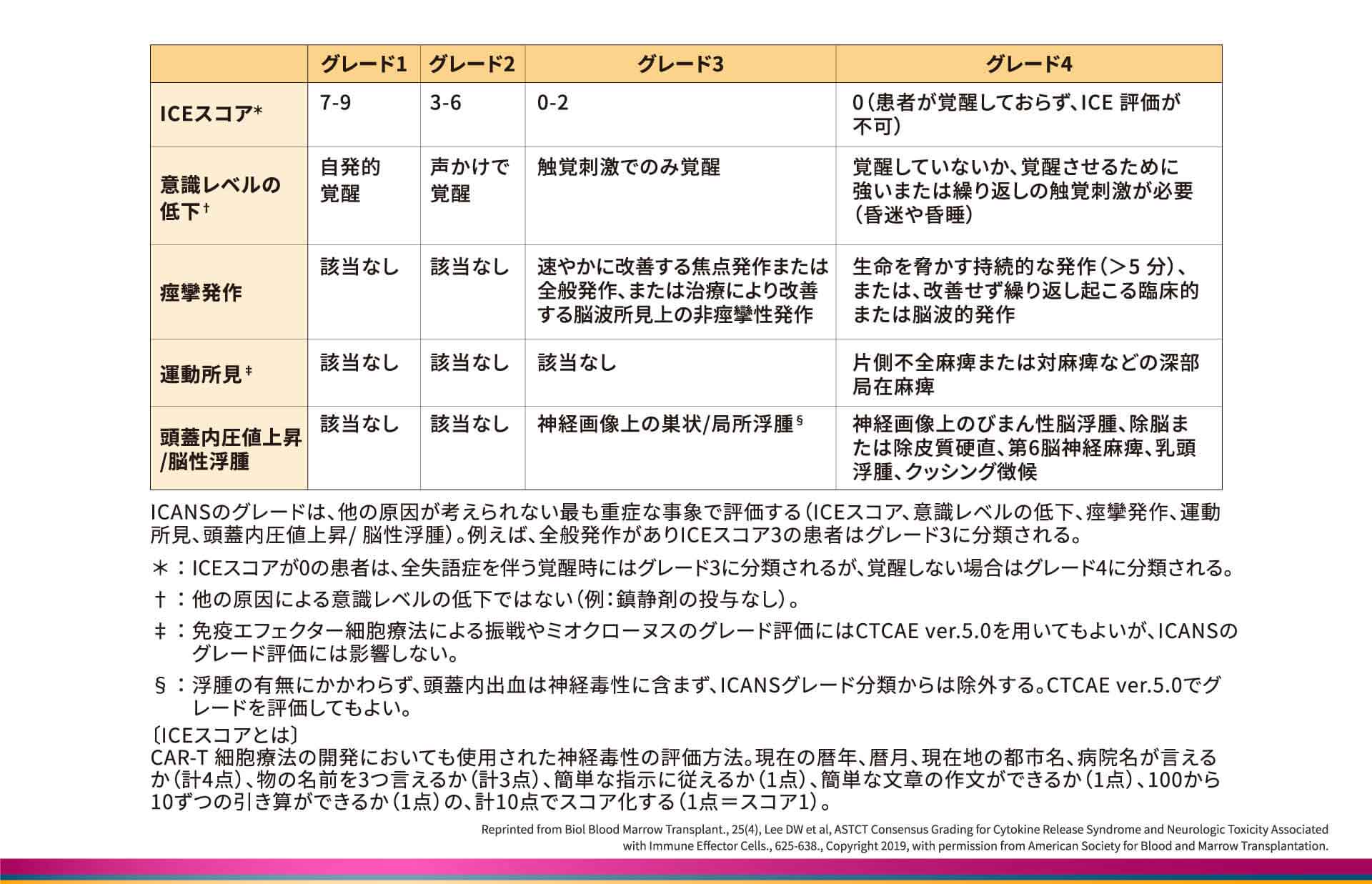
成人における神経学的事象のグレードは、免疫エフェクター細胞関連脳症(ICE;Immune effector cell-associated encephalopathy)スコア、意識レベル、痙攣発作、運動所見、頭蓋内圧値上昇/脳性浮腫の有無と程度で評価し、ICEスコアが0~2の場合はグレード3以上となります8)。
CAPDを用いたICANSのグレード分類(12歳未満)
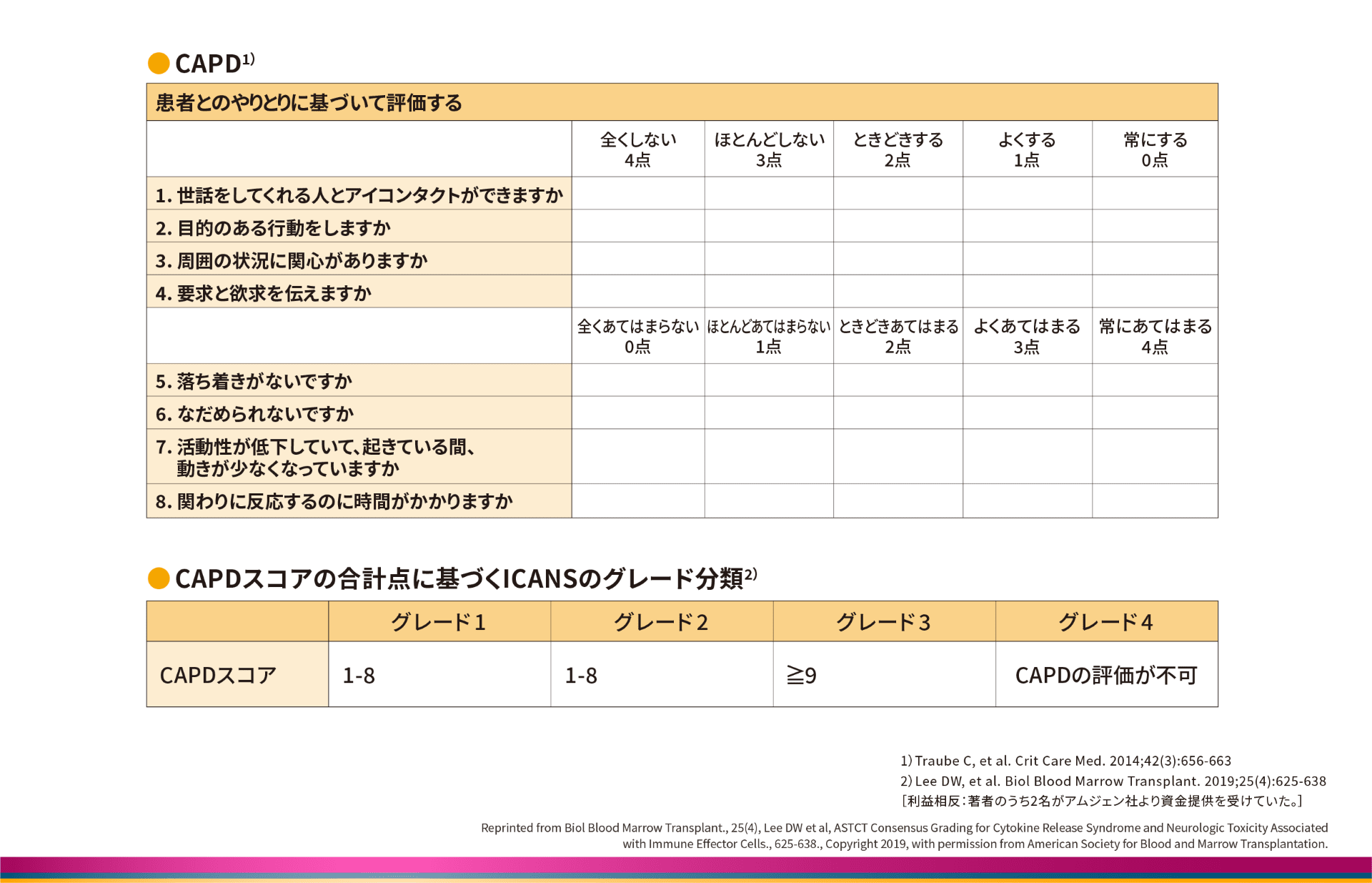
12歳未満の小児では、ICEスコアの適切な評価が困難なため、神経学的事象の全般評価にはCornell Assessment of Pediatric Delirium(CAPD)を用いることが推奨されています8,9)。
ビーリンサイトによるCRSの予防と管理
「警告・禁忌を含む注意事項等情報」等は、電子化された添付文書をご参照ください。
[参考]臨床試験におけるCRSの発現状況
![[参考]臨床試験におけるCRSの発現状況](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/blincyto/expert/expert_commentary08/slide05.jpg?h=1239&iar=0&w=1920&hash=8242BCA073AA8EA644A7C2D17693CEFC)
ビーリンサイトは、初回サイクル時に低用量で投与開始することで、CRSの発現リスクが低下します10,11)。ビーリンサイトの海外第Ⅲ相比較対照臨床試験(TOWER試験)1)におけるビーリンサイト群のCRSの初回発現までの期間中央値(範囲)は2.0(1~254)日でした。CRSの予防には、デキサメタゾンの前治療と前投与の実施が有効です。一般的にステロイドはT細胞活性に影響を及ぼすため、ビーリンサイトの有効性に影響を与える可能性が考えられますが、デキサメタゾンの前治療は、ビーリンサイトの有効性を減弱させないことが報告されています10)。
ステロイドがCRSの症状のコントロールに有用であることが報告されており10)、臨床試験においては、発熱全般に対して、第一選択薬としてアセトアミノフェンもしくはデキサメタゾンの投与が推奨されていました1,12)。
デキサメタゾンによる前治療・前投与

ビーリンサイトによる神経学的事象の予防と管理
[参考]臨床試験における神経学的事象の発現状況
![[参考]臨床試験における神経学的事象の発現状況](-/media/Themes/Amgen/amgenpro-jp/amgenpro-jp/Images/Content/blincyto/expert/expert_commentary08/slide07.jpg?h=1236&iar=0&w=1920&hash=D181B6A99399581CA848157F4BCD42D1)
ビーリンサイトの海外第Ⅲ相比較対照臨床試験(TOWER試験)1)におけるビーリンサイト群の神経学的事象の初回発現までの期間中央値(範囲)は8.0(1~190)日であり、1サイクル目に発現することが多いと考えられます。神経学的事象が発現した場合には、臨床試験では対処法としてデキサメタゾンが投与されており、神経学的事象が痙攣であった場合には、適切な抗痙攣薬が投与されていました13)。
神経学的事象は早期発見が重要であると考えられます。CAR-T細胞療法において書字障害の発現が神経学的事象の徴候であったとの報告があることから14)、簡単な文章を書かせるライティングテストを実施し、神経学的事象の早期発見に役立てている施設もあります。
デキサメタゾンによる前治療・前投与

ビーリンサイトの電子化された添付文書では、神経学的事象の発現を軽減するため、骨髄中の白血病性芽球の割合が50%超または末梢血中の白血病性芽球数が15,000/μL以上の場合には、デキサメタゾンの前治療を行うことが推奨されています。
我が国におけるコンセンサスの必要性
このように、ビーリンサイトなどの免疫療法ではCRSや神経学的事象の発現リスクが高まるため、適切な予防・管理が必要です。
今後は、実臨床でも安全性のエビデンスが蓄積され、最適な予防・管理法が確立することが期待されますが、海外ではすでにCRSおよび神経学的事象の重症度分類のコンセンサスが提案されており8)、我が国においても、ALL 治療の均てん化を進めるために、免疫療法に特徴的な毒性を適切に評価し、マネジメントするためのコンセンサスの作成を進めることが重要であると考えられます。
-
References
- 承認時評価資料(海外第Ⅲ相比較対照臨床試験(0010
3311 試験)) - Aldoss I, et al. Curr Oncol Rep. 2019;21(1):4
[利益相反:著者のうち1名がアムジェン社より資金提供を受けていた。] - Maude SL, et al. N Engl J Med. 2018;378(5):439-448
- Hay KA, et al. Blood. 2017;130(21):2295
-2306 - Davila ML, et al. Sci Transl Med. 2014;6(224):224ra25
- Porter DL, et al. Sci Transl Med. 2015;7(303):303ra139
- Lee DW, et al. Blood. 2014;124(2):188-195
- Lee DW, et al. Biol Blood Marrow Transplant. 2019;25(4):625-638
[利益相反:著者のうち2名がアムジェン社より資金提供を受けていた。] - Traube C, et al. Crit Care Med. 2014;42(3):656-663
- Topp MS, et al. Lancet Oncol. 2015;16(1):57-66
[利益相反:本試験はアムジェン社・アステラス製薬の支援により行われた。] - Nägele V, et al. Exp Hematol Oncol. 2017;6:14
[利益相反:本試験はアムジェン社の支援により行われた。] - 承認時評価資料(海外第Ⅱ相臨床試験(20120216 試験))
- 承認時評価資料(国内第Ⅰb/Ⅱ相臨床試験(20130265 試験))
- Neelapu SS, et al. Nat Rev Clin Oncol. 2018;15(1):47-62
- 承認時評価資料(海外第Ⅲ相比較対照臨床試験(0010


















