主な副作用と対処 1)
国内臨床試験(20130265 試験)において報告された主な副作用
18 歳以上の患者においては 26 例中 26 例(100.0%)に、臨床検査値異常や下記を含む副作用が認められました(全グレード)。
- サイトカイン放出症候群 12 例(46.2%)
- 発熱 12 例(46.2%)
- 好中球減少 10 例(38.5%)
- 血小板減少 9 例(34.6%)
18 歳未満の患者においては 9 例中 8 例(88.9%)に、臨床検査値異常や下記を含む副作用が認められました(全グレード)。
- 肝酵素上昇 6 例(66.7%)
- 発熱 6 例(66.7%)
- サイトカイン放出症候群 5 例(55.6%)
- 腹痛 4 例(44.4%)
副作用による用量調節基準
| 副作用 | グレード注) | 対 処 |
|---|---|---|
|
サイトカイン 放出症候群 |
成人(18歳以上):3 小児(18歳未満):2または3 |
• 回復するまで投与中断 • 投与再開する場合は、「45kg以上:1日9μg」「45kg未満:1日5μg/m²」から開始 • サイトカイン放出症候群の所見が再度認められなければ、投与再開後8日目以降に「45kg以上:1日28μg」「45kg未満:1日15μg/m²」に増量できる |
| 4 | • 投与中止 | |
| 神経学的事象 | 痙攣発作 | • 2回以上発現した場合には、投与中止 |
|
成人(18歳以上):3 小児(18歳未満):2または3 |
• グレード1以下が3日間継続するまで投与中断 • 投与再開する場合は「45kg以上:1日9μg」「45kg未満:1日5μg/m2」で投与し、増量しないこと • 「45kg以上:1日9μg」「45kg未満:1日5μg/m2」で投与中にグレード3以上の神経学的事象が発現、あるいは回復までに8日間以上要した場合は投与中止 |
|
| 4 | • 投与中止 | |
| その他の副作用 | 3 |
• グレード1以下になるまで投与中断 • 投与再開する場合は「45kg以上:1日9μg」「45kg未満:1日5μg/m²」から開始 • 副作用が再度認められなければ、投与再開後8日目以降に「45kg以上:1日28μg」「45kg未満:1日15μg/m²」に増量できる |
| 4 | • 投与中止 |
注)グレードは NCI-CTCAE に準じる。
参考:有害事象共通用語規準 v5.0 日本語訳 JCOG 版(CTCAE v5.0-JCOG)より引用、改変
[CTCAE v5.0/MedDRA v20.1(日本語表記:MedDRA/J v27.1)対応 - 2024 年 9 月 1 日] JCOG ホームページ(http://www.jcog.jp)
| グレード 1 | グレード 2 | グレード 3 | グレード 4 | グレード 5 | |
|---|---|---|---|---|---|
|
サイトカイン 放出症候群※1 |
全身症状の有無は 問わない発熱 |
輸液に反応する低血圧; <40%の酸素投与に反応する 低酸素症 |
昇圧剤単剤で管 理できる低血圧;
≧40%の酸素投 与を要する低酸 素症 |
生命を脅かす; 緊急処 置を要する | 死亡 |
| 痙攣発作※2 | 短い部分痙攣発作 はあるが,意識障害 はない |
短い全身性痙攣発 作 | 痙攣発作の新規 発症(部分痙攣 発作または全身 性痙攣発作);内 科的治療を行っ ているにもかか わらず繰り返し 起こる痙攣発作 | 生命を脅かす; 遷延す る痙攣発作の重積状 態 | 死亡 |
※1:サイトカインの放出により引き起こされる、発熱、頻呼吸、頭痛、頻脈、低血圧、皮疹、低酸素症
※2:大脳または脳幹由来の、突然の不随意な骨格筋の攣縮
投与の中断後の再開方法
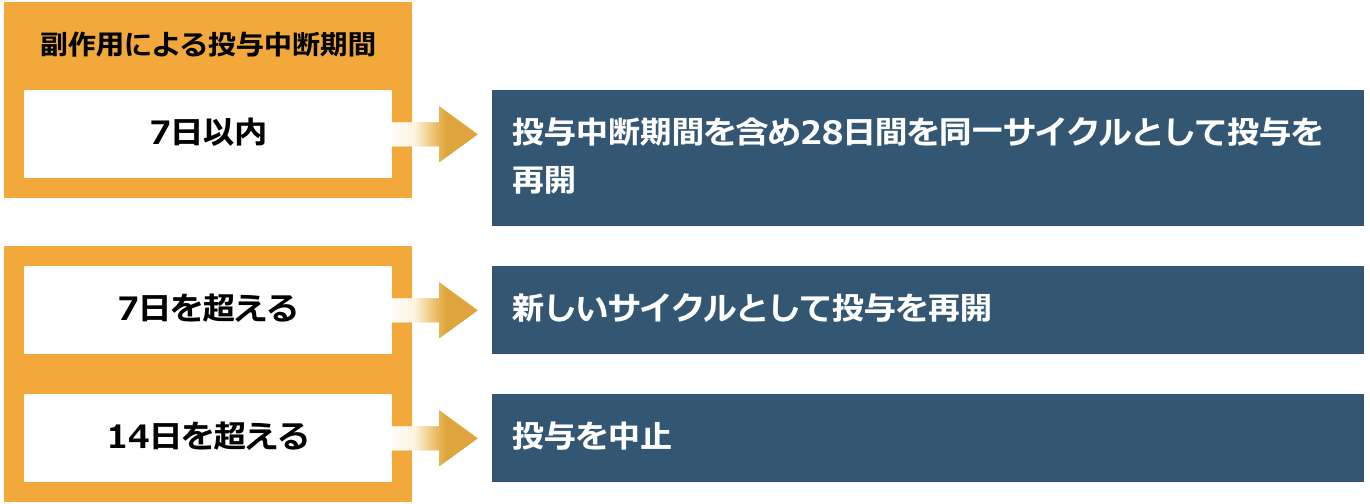
※投与中断後、投与を再開する場合もデキサメタゾンによる前投与を行ってください。
投与時の注意点
投与時の基本事項
無菌フィルター(0.2μm)付き輸液セットを接続した輸液ポンプ(流速を適切に管理可能なもの)を用いて、投与時間に応じた注入速度に従って持続点滴静注してください。
| 投与時間 | 注入速度 |
|---|---|
| 24 時間 | 10mL/時間 |
| 48 時間 | 5mL/時間 |
| 72 時間 | 3.3mL/時間 |
| 96 時間 | 2.5mL/時間 |
重要:投与ラインや静脈カテーテルのフラッシュ禁止
※過量投与などの原因となります。
交換のタイミングについて
- 輸液バッグの交換は医療従事者が行ってください。
- ビーリンサイト輸液バッグは、投与スケジュールに準じて交換してください。
- 輸液チューブやビーリンサイト輸液バッグに溶液が残っていても、設定した投与時間が経過したタイミングで交換してください※。
※ビーリンサイト輸液バッグには投与量よりも多く薬剤が添加されており、輸液を全量投与すると過量投与となります。
廃棄方法について
- ビーリンサイトは、細胞傷害性のある薬剤ではありません。ビーリンサイト輸液バッグ内の残液は、ご施設の廃棄ルールに従って、適切に廃棄してください。
投与前の確認
投与を開始する前に再度確認をしてください。
| 投与内容の確認 | 関連情報 記載ページ |
|
|---|---|---|
| 何サイクル目の、何日目かを確認しましたか? |
詳しくは こちら |
|
| 体重・投与用量は確認しましたか? |
詳しくは こちら |
|
|
デキサメタゾンによる前治療を行いましたか?
(骨髄中の白血病性芽球の割合が 50%超、または末梢血中の白血病性芽球数が 15,000/μL 以上の患者の場合)
|
詳しくは こちら |
|
| デキサメタゾンの前投与を行いましたか? |
詳しくは こちら |
|
| 用意したビーリンサイト輸液バッグは正しいものですか? | ||
| 投与時間は確認しましたか? 24 時間、48 時間、72 時間、96 時間 |
詳しくは こちら |
|
|
注入速度は確認しましたか?
10mL/時間、5mL/時間、3.3mL/時間、2.5mL/時間
|
詳しくは こちら |
|
| 投与手順の確認 | ||
| ビーリンサイト輸液バッグに輸液セットを接続しましたか? | ||
| 無菌フィルター(0.2μm)付き輸液セットが接続されていますか? | ||
| 輸液チューブは調製済溶液でプライミングされていますか? | ||
| 輸液ポンプを正しくセットしましたか? | ||
| 投与ラインや静脈カテーテルはフラッシュ禁止です | ||
-
References
- 承認時評価資料(国内第Ⅰb/Ⅱ相試験(20130265 試験))












